Ácido-Base de Lewis
2 participantes
Página 1 de 1
 Ácido-Base de Lewis
Ácido-Base de Lewis
Analisando as espécies a seguir:
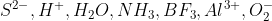
Podemos concluir, segundo o conceito de Lewis, que:
01. H+ , NH3 e BF3 são ácidos.
02. H2O, S2– e Aℓ 3+ são bases.
04. São ácidos H+ , BF3 e Aℓ 3+ .
08. São bases apenas S2– e O2– .
16. São bases S2– , H2O, NH3 e O2– .
SOMA(20)
Não entendi o pq me expliquem pfv
Podemos concluir, segundo o conceito de Lewis, que:
01. H+ , NH3 e BF3 são ácidos.
02. H2O, S2– e Aℓ 3+ são bases.
04. São ácidos H+ , BF3 e Aℓ 3+ .
08. São bases apenas S2– e O2– .
16. São bases S2– , H2O, NH3 e O2– .
SOMA(20)
Não entendi o pq me expliquem pfv

Oziel- Estrela Dourada

- Mensagens : 1517
Data de inscrição : 26/04/2016
Idade : 25
Localização : São Pedro da Aldeia-RJ
 Re: Ácido-Base de Lewis
Re: Ácido-Base de Lewis
Fala ae cara... Para entender como funciona essa classificação de Lewis, tem que entender bem a teoria do octeto e a representação de Lewis para as ligações químicas.oziel_w escreveu:Analisando as espécies a seguir:
Podemos concluir, segundo o conceito de Lewis, que:
01. H+ , NH3 e BF3 são ácidos.
02. H2O, S2– e Aℓ 3+ são bases.
04. São ácidos H+ , BF3 e Aℓ 3+ .
08. São bases apenas S2– e O2– .
16. São bases S2– , H2O, NH3 e O2– .
SOMA(20)
Não entendi o pq me expliquem pfv
Vamos ver se eu consigo explicar essa.
Partindo da definição:
- Ácido de Lewis: é toda espécie química capaz de receber um par de elétrons;
- Base de Lewis: é toda espécie capaz de doar um par de elétrons.
Então, vamos analisar:
H+ --> Ácido de LEWIS! Uma vez que ele é um reagente eletrófilo (necessita de um par de elétrons durante uma reação orgânica) Repare, por exemplo o HCL, se for dissociado, vai liberar H+ E CL-, Nesse caso o Hidrogênio ficará sem um par de elétrons e, como a definição, ele FICA CAPAZ DE RECEBER UM PAR DE ELÉTRONS.
BF3 --> Ácido de LEWIS! Esse composto é clássico quando se trata desse assunto. o BORO é uma exceção da regra do OCTETO, pois ele possui a camada de valência incompleta, com seis elétrons. Por isso, pode receber um par de elétrons, realizando ligações covalentes.
Al 3+ --> Ácido de LEWIS! O alumínio é um ácido de Lewis porque o alumínio é um átomo que apresenta três elétrons na camada de valência, quando ele perde esses elétrons ele PODE RECEBER PARES DE ELÉTRONS.
Para as bases:
S2- --> Base de Lewis! O S2- recebe dois elétrons e, em razão disso, pode doa par de elétrons também!
H2O --> Base de Lewis! A água tem uma estrutura angular. O oxigênio possui seis elétrons na camada de valência e realiza ligações covalentes com o hidrogênio, compartilhando dois desses elétrons e SOBRANDO DOIS PARES DE ELÉTRONS QUE PODEM SER DOADOS! obs: Esse par de elétrons livres é um dos fatores que também justifica a geometria angular da água.
NH3 --> Base de Lewis! o nitrogênio é da família 5A e, portanto, possui 5 elétrons na camada de valência. Ele vai compartilhar 3 desses elétrons com os hidrogênios e vai sobrar UM PAR DE ELÉTRON QUE PODE SER DOADO!
O2- --> o oxigênio vai receber dois elétrons e, em razão disso, pode doar par de elétrons!
Cara, tentei explicar mais ou menos ai.. Deu pra ter entender?
Abraço!

Carlos Augusto Parente- Recebeu o sabre de luz

- Mensagens : 137
Data de inscrição : 09/04/2017
Idade : 28
Localização : Niteroi, Rio de Janeiro, Brasil
 Re: Ácido-Base de Lewis
Re: Ácido-Base de Lewis
Entendi perfeitamente amigão, muito obrigado !

Oziel- Estrela Dourada

- Mensagens : 1517
Data de inscrição : 26/04/2016
Idade : 25
Localização : São Pedro da Aldeia-RJ
 Tópicos semelhantes
Tópicos semelhantes» Ácido e Base de Lewis
» Ácido/base de Lewis
» Ácido e Base de Lewis
» Acido Lewis
» Reação ácido-base de Lewis
» Ácido/base de Lewis
» Ácido e Base de Lewis
» Acido Lewis
» Reação ácido-base de Lewis
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













