Geometria molecular
2 participantes
Página 1 de 1
 Geometria molecular
Geometria molecular
[UFRGS] O dióxido de enxofre, em contato com o ar, forma trióxido de enxofre que, por sua vez, em contato com a água, forma ácido sulfúrico. Na coluna da esquerda, abaixo, estão listadas 5 substâncias envolvidas nesse processo. Na coluna da direita, características das moléculas dessa substância.
1 - SO2 ( ) tetraédrica, polar
2 - SO3 ( ) angular, polar
3 - H2SO4 ( ) linear, apolar
4 - H2O ( ) trigonal, apolar
5 - O2
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
A) 1 – 4 – 3 – 2.
B) 2 – 3 – 5 – 1.
C) 2 – 3 – 4 – 5.
D) 3 – 1 – 5 – 2.
E) 3 – 4 – 2 – 1.
1 - SO2 ( ) tetraédrica, polar
2 - SO3 ( ) angular, polar
3 - H2SO4 ( ) linear, apolar
4 - H2O ( ) trigonal, apolar
5 - O2
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
A) 1 – 4 – 3 – 2.
B) 2 – 3 – 5 – 1.
C) 2 – 3 – 4 – 5.
D) 3 – 1 – 5 – 2.
E) 3 – 4 – 2 – 1.
Cínthia Brito- Iniciante
- Mensagens : 25
Data de inscrição : 14/03/2020
 Re: Geometria molecular
Re: Geometria molecular
Olá Cínthia.
Você deve desenhar a estrutura de Lewis e levar em conta os postulados do VSEPR.
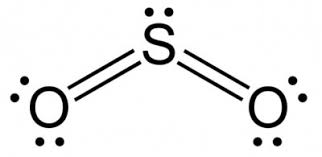
Note que a estrutura de Lewis para o dióxido de enxofre, temos 3 orbitais, 2 híbridos (orbitais híbridos fazendo ligação com oxigênio) e um orbital com um par de elétron isolado no átomo central. O postulado do VSEPR nos diz que esses orbitais ficam o mais afastado possível, a melhor configuração energética é obtida quando esses orbitais se repelem o mínimo possível. Devido a esse orbital isolado no átomo central, para se afastar dos híbridos, a molécula tende a curvar-se, caracterizando um estrutura angular. Os vetores dipolos apontam do enxofre para o oxigênio. Devido a essa inclinação, eles não se cancelam e a molécula tem vetor polar resultante não nulo.

Para o trióxido de enxofre a regra é a mesma, depois de desenhar a estrutura de Lewis, nota que há 3 orbitais híbridos, nenhum orbital com par de elétrons isolado, apenas 3 orbitais, a melhor configuração é a configuração mais distante entre eles, no caso, vão formar um ângulo de 120º um em relação ao outro, assumindo a configuração de triângulo plano, ou trigonal planar. Temos 3 vetores idênticos em 120º, a resultante de dois deles terá o mesmo módulo dos 3 e estará na bissetriz dos dois considerados, isso implicar que estará igualmente direcionado ao terceiro, de modo que a resultante é nula e a molécula é apolar.
Essa análise já é o suficiente para concluir o exercício, letra D.
Você deve desenhar a estrutura de Lewis e levar em conta os postulados do VSEPR.

Note que a estrutura de Lewis para o dióxido de enxofre, temos 3 orbitais, 2 híbridos (orbitais híbridos fazendo ligação com oxigênio) e um orbital com um par de elétron isolado no átomo central. O postulado do VSEPR nos diz que esses orbitais ficam o mais afastado possível, a melhor configuração energética é obtida quando esses orbitais se repelem o mínimo possível. Devido a esse orbital isolado no átomo central, para se afastar dos híbridos, a molécula tende a curvar-se, caracterizando um estrutura angular. Os vetores dipolos apontam do enxofre para o oxigênio. Devido a essa inclinação, eles não se cancelam e a molécula tem vetor polar resultante não nulo.

Para o trióxido de enxofre a regra é a mesma, depois de desenhar a estrutura de Lewis, nota que há 3 orbitais híbridos, nenhum orbital com par de elétrons isolado, apenas 3 orbitais, a melhor configuração é a configuração mais distante entre eles, no caso, vão formar um ângulo de 120º um em relação ao outro, assumindo a configuração de triângulo plano, ou trigonal planar. Temos 3 vetores idênticos em 120º, a resultante de dois deles terá o mesmo módulo dos 3 e estará na bissetriz dos dois considerados, isso implicar que estará igualmente direcionado ao terceiro, de modo que a resultante é nula e a molécula é apolar.
Essa análise já é o suficiente para concluir o exercício, letra D.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1703
Data de inscrição : 15/12/2018
Idade : 22
Localização : São Paulo
 Tópicos semelhantes
Tópicos semelhantes» Geometria Molecular
» Geometria molecular
» Geometria molecular
» Geometria molecular
» geometria molecular
» Geometria molecular
» Geometria molecular
» Geometria molecular
» geometria molecular
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













