Hibridização
2 participantes
PiR2 :: Química :: Química Orgânica
Página 1 de 1
 Hibridização
Hibridização
(ITA-SP) A(s) ligação(ões) carbono-hidrogênio existente(s) na molécula de metano (CH4 ) pode(m) ser interpretada(s) como sendo formada(s) pela interpenetração frontal dos orbitais atômicos s do átomo de hidrogênio, com os seguintes orbitais atômicos do átomo de carbono:
a) Quatro orbitais p.
b) Quatro orbitais sp3 .
c) Um orbital híbrido sp3 .
d) Um orbital s e três orbitais p.
e) Um orbital p e três orbitais sp2 .
Dúvida: O que invalida a C? É errado afirmar que o orbital s de um átomo de H irá interpenetrar-se com um orbital híbrido sp3 do C?
a) Quatro orbitais p.
b) Quatro orbitais sp3 .
c) Um orbital híbrido sp3 .
d) Um orbital s e três orbitais p.
e) Um orbital p e três orbitais sp2 .
- spoiler:
- B
Dúvida: O que invalida a C? É errado afirmar que o orbital s de um átomo de H irá interpenetrar-se com um orbital híbrido sp3 do C?
Última edição por acmoribe em Seg 27 Abr 2020, 19:07, editado 1 vez(es)

Lingered- Iniciante
- Mensagens : 34
Data de inscrição : 16/02/2020
Idade : 24
Localização : Araguaína-TO
Queiroz2001UFBA gosta desta mensagem
 Re: Hibridização
Re: Hibridização
Olá. Dê uma olhada no aspecto físico dos orbitais hibridizados.
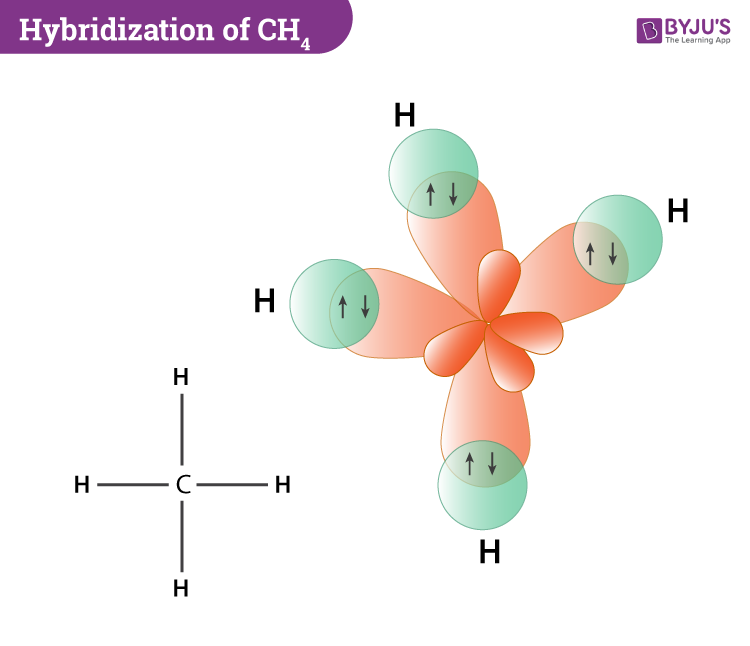
A configuração por ti sugerida implicaria que os 4 orbitais estivessem juntos. Para isso, os orbitais do C teriam que estar em contato. Pelo VSEPR sabemos que eles tendem a ficar o mais afastado possível (na verdade tendem a minimizar a energia do sistema mas isso implica maior separação quase sempre). Então, cada orbital hibridiza separadamente com o orbital do H. Para juntar orbitais seria necessário vencer as repulsões dos orbitais, o que necessitaria de energia.

A configuração por ti sugerida implicaria que os 4 orbitais estivessem juntos. Para isso, os orbitais do C teriam que estar em contato. Pelo VSEPR sabemos que eles tendem a ficar o mais afastado possível (na verdade tendem a minimizar a energia do sistema mas isso implica maior separação quase sempre). Então, cada orbital hibridiza separadamente com o orbital do H. Para juntar orbitais seria necessário vencer as repulsões dos orbitais, o que necessitaria de energia.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1722
Data de inscrição : 15/12/2018
Idade : 23
Localização : São Paulo
Queiroz2001UFBA gosta desta mensagem
 Re: Hibridização
Re: Hibridização
"pela interpenetração frontal dos orbitais atômicos s do átomo de hidrogênio", acho que "engoli" essa parte.
"A(s) ligação(ões) carbono-hidrogênio existente(s) na molécula de metano (CH4)" Interpretei mal
Muito obrigada
"A(s) ligação(ões) carbono-hidrogênio existente(s) na molécula de metano (CH4)" Interpretei mal
Muito obrigada

Lingered- Iniciante
- Mensagens : 34
Data de inscrição : 16/02/2020
Idade : 24
Localização : Araguaína-TO
Queiroz2001UFBA gosta desta mensagem
 Re: Hibridização
Re: Hibridização
acmoribe escreveu:"pela interpenetração frontal dos orbitais atômicos s do átomo de hidrogênio", acho que "engoli" essa parte.
"A(s) ligação(ões) carbono-hidrogênio existente(s) na molécula de metano (CH4)" Interpretei mal
Muito obrigada
Acontece. Por nada
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1722
Data de inscrição : 15/12/2018
Idade : 23
Localização : São Paulo
Queiroz2001UFBA gosta desta mensagem
PiR2 :: Química :: Química Orgânica
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













