Ligação Covalente
2 participantes
Página 1 de 1
 Ligação Covalente
Ligação Covalente
Por que o Berílio (metal) faz ligação covalente quando ligado a um ametal? Não deveria ser ligação iônica? Além dele, mais algum metal foge à regra? Não encontro essa resposta em lugar nenhum. Obrigado
João Deport- Iniciante
- Mensagens : 2
Data de inscrição : 05/04/2020
 Re: Ligação Covalente
Re: Ligação Covalente
Uma pergunta antes. Já estudou hibridação de orbitais?
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1722
Data de inscrição : 15/12/2018
Idade : 23
Localização : São Paulo
 Re: Ligação Covalente
Re: Ligação Covalente
Antes de tudo, vou usar o conceito de contribuição, quando me refiro a contribuição me refiro a contribuição que uma certa propriedade fornece a energia do composto.
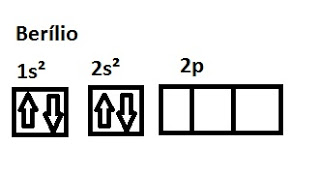
O berílio apresenta alta energia de ionização, esperado, sendo um metal, mas também apresenta uma alta capacidade de hibridizar (fazer ligações covalentes).
A questão é a seguinte:
claramente o Berílio possui os orbitais completos, acrescentar elétrons, no geral não é energeticamente favorável (não contribui para o composto formado).
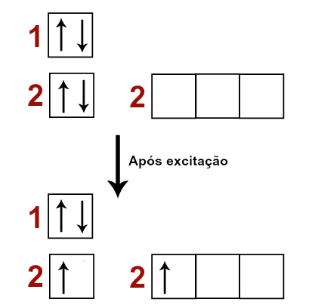
Mas um caso mais incomum ocorre, o mesmo ocorre com carbono (desenhe o diagrama de orbitais do carbono e tente explicar o fato de, no geral, ele ser fazer 4 ligações), o berílio passa por um fenômeno chamado de excitação. Em alguns casos ele pode entrar no estado excitado. Isso significa que, ele faz elétron(s) saltar(em) do orbital completo para uma camada superior.
Veja, agora sim, há o orbitais incompletos, portanto agora, faz sentido o metal fazer ligações covalentes.
A questão é que o somatório de contribuição para o elétron saltar de camadas e fazer ligações covalentes é maior que simplesmente perder 2 elétrons. Isto é, o composto precisa de menor energia no estado excitado do que no estado iônico. Para Química, o menor nível de energia é sempre o mais estável. Quanta a explicação do motivo dessa diferença não é muito simples, acredito que envolva até blindagem, mas se estiver muito curioso procure pelo motivo do carbono fazer 4 ligações em alguns sites mais aprofundados devem dar a explicação da energia.
____________________________________________
El Álgebra no es más que Geometría y la Geometría no es más que Álgebra abstracta
Sophie Germain
Sophie Germain
Emanuel Dias- Monitor

- Mensagens : 1722
Data de inscrição : 15/12/2018
Idade : 23
Localização : São Paulo
 Re: Ligação Covalente
Re: Ligação Covalente
Rapaz, excelente explicação. Estou estudando hibridação de orbitais agora. Sobre o motivo do carbono fazer 4 ligações, vou procurar,sim. Muito obrigado! Ajudou bastante. 



João Deport- Iniciante
- Mensagens : 2
Data de inscrição : 05/04/2020
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos