(Ufal) Pilhas
3 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 2
Página 1 de 2 • 1, 2 
 (Ufal) Pilhas
(Ufal) Pilhas
Considere as informações a seguir.
Alguns pregos galvanizados (ferro recoberto de zinco) foram adicionados a uma solução aquosa de iodo (contendo iodeto, I-) de coloração vermelha. A solução descorou.
À solução descorada adicionou-se água de lavadeira (solução aquosa de hipoclorito de sódio). Apareceu um precipitado branco e voltou a cor vermelha.
Com base nos conhecimentos dos potenciais de redução abaixo,
Zn+2 + 2e → Zn -0,76 volt
I2 + 2e → 2I- +0,54 volt
H2O + ClO- + 2e → Cl- + 2OH- +0,89 volt
pode-se explicar o ocorrido afirmando que:
I.a solução descorou porque o iodo se reduziu a custa do zinco que se oxidou.
II.o precipitado branco formato é Zn(OH)2 produzido por ZN2+ + 2OH.
III.a água de lavadeira reduz iodo a iodeto (I-) o que justifica a volta da coloração.
Dessas afirmações, SOMENTE
a) I é correta.
b) II é correta.
c) III é correta.
d) I e II são corretas.
e) II e III são corretas.
Estou com dúvidas principalmente sobre o porquê dessas colorações (e por que descorou) e quanto ao processo de formação do precipitado...
Alguns pregos galvanizados (ferro recoberto de zinco) foram adicionados a uma solução aquosa de iodo (contendo iodeto, I-) de coloração vermelha. A solução descorou.
À solução descorada adicionou-se água de lavadeira (solução aquosa de hipoclorito de sódio). Apareceu um precipitado branco e voltou a cor vermelha.
Com base nos conhecimentos dos potenciais de redução abaixo,
Zn+2 + 2e → Zn -0,76 volt
I2 + 2e → 2I- +0,54 volt
H2O + ClO- + 2e → Cl- + 2OH- +0,89 volt
pode-se explicar o ocorrido afirmando que:
I.a solução descorou porque o iodo se reduziu a custa do zinco que se oxidou.
II.o precipitado branco formato é Zn(OH)2 produzido por ZN2+ + 2OH.
III.a água de lavadeira reduz iodo a iodeto (I-) o que justifica a volta da coloração.
Dessas afirmações, SOMENTE
a) I é correta.
b) II é correta.
c) III é correta.
d) I e II são corretas.
e) II e III são corretas.
Estou com dúvidas principalmente sobre o porquê dessas colorações (e por que descorou) e quanto ao processo de formação do precipitado...
André Sardinha Bontempo- Iniciante
- Mensagens : 23
Data de inscrição : 03/08/2016
Idade : 40
Localização : Primavera do Leste, MT, Brasil
 Re: (Ufal) Pilhas
Re: (Ufal) Pilhas
Proposição I:
Semi reação de redução do I- a I2 que implicou na descoloração da solução:
I2 + 2e- → 2I-
Inicialmente, a questão nos diz que a solução de iodo possui coloração vermelha, mas, quando adicionado ferro recoberto de zinco a esta solução ela se descolore. Isso leva-nos a crer que a coloração da solução era vermelha devido à presença de íons I-, os quais ao sofrerem redução (é possível deduzir que os íons I- sofreram redução observando os dados da tabela, pela qual inferimos que o iodo possui tendência de receber elétrons e, portanto, sofrer redução e o zinco de doar elétrons e, consequentemente, sofrer oxidação), causaram a descoloração da solução. Portanto, a proposição I está correta.
Proposição II:
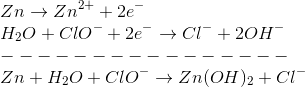
No geral, as bases solúveis são àquelas que são formadas por metais alcalinos (família IA). As que são formadas por metais alcalinos terrosos (família 2A) estão na posição intermediária e as demais são praticamente insolúveis. Portanto, a proposição II está correta, visto que o Zn é um metal de transição e, portanto, formará o precipitado branco.
Proposição III: Pelos dados da tabela, seria um pouco mais difícil de ocorrer a reação de oxirredução entre o iodo e a água de lavadeira, pois observando os potenciais de redução das semi reações que possuem potenciais positivos, verifica-se que tanto o iodo quanto a água de lavadeira possuem a tendência de receber elétrons. Portanto, a proposição III está incorreta.
Semi reação de redução do I- a I2 que implicou na descoloração da solução:
I2 + 2e- → 2I-
Inicialmente, a questão nos diz que a solução de iodo possui coloração vermelha, mas, quando adicionado ferro recoberto de zinco a esta solução ela se descolore. Isso leva-nos a crer que a coloração da solução era vermelha devido à presença de íons I-, os quais ao sofrerem redução (é possível deduzir que os íons I- sofreram redução observando os dados da tabela, pela qual inferimos que o iodo possui tendência de receber elétrons e, portanto, sofrer redução e o zinco de doar elétrons e, consequentemente, sofrer oxidação), causaram a descoloração da solução. Portanto, a proposição I está correta.
Proposição II:
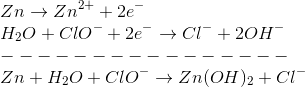
No geral, as bases solúveis são àquelas que são formadas por metais alcalinos (família IA). As que são formadas por metais alcalinos terrosos (família 2A) estão na posição intermediária e as demais são praticamente insolúveis. Portanto, a proposição II está correta, visto que o Zn é um metal de transição e, portanto, formará o precipitado branco.
Proposição III: Pelos dados da tabela, seria um pouco mais difícil de ocorrer a reação de oxirredução entre o iodo e a água de lavadeira, pois observando os potenciais de redução das semi reações que possuem potenciais positivos, verifica-se que tanto o iodo quanto a água de lavadeira possuem a tendência de receber elétrons. Portanto, a proposição III está incorreta.

Giovana Martins- Grande Mestre

- Mensagens : 8545
Data de inscrição : 15/05/2015
Idade : 24
Localização : São Paulo
 Re: (Ufal) Pilhas
Re: (Ufal) Pilhas
O iodo (I2) é uma metal sólido e pouco solúvel em água, mas se dissolve bem em soluções de iodetos (NaI, KI etc,) e em compostos orgânicos polares, como o etanol (álcool), e apolares, como o hexano e o tetracloreto de carbono.
Nas soluções orgânicas polares ele as deixa com coloração amarronzada, típica do "iodo", aquela tintura de iodo no álcool, que passávamos nos arranhões e ardia (por causa do álcool, não pelo iodo) ...
Já as apolares ficam na cor violeta, de onde vem o nome do iodo ( do grego ἰιώδης, iodes, "violeta" ), a mesma cor da fumaça dos vapores do iodo sublimado.
Ao se dissolver em soluções inorgânicas de iodetos, ele forma um íon com coloração vermelha, o TRIIODETO [I3]− .
Formação do TRIIODETO:
I2 + I− ⇌ [I3]−
Quando o zinco entra em cena, reage com o triiodeto [I3]− e, consequentemente, com a coloração vermelha da solução.
Formação do Zn2+(aq) :
Zn + 2 [I3]− ⇌ Zn2+(aq) + 2 I2 + 2 I −
Nesse processo cíclico, a solução fica somente com os íons (Zn2+) e iodeto (I−), continuando assim até se colocar a água sanitária (hipoclorito de sódio), a qual, na solução aquosa, está dissociada, gerando o ânion hipoclorito ([ClO]−):
NaClO + H2O ⇌ Na+ + [ClO]−
O hipoclorito na solução aquosa pode se dissociar, gerando:
[ClO]- + H2O + 2e ⇌ Cl− + 2 [OH]−
Então, as hidroxilas ([OH]− ) na solução formam um composto muito pouco solúvel com o íon zinco (Zn2+) , o hidróxido de zinco :
Zn2+ + 2 [OH]− → Zn (OH)2 ↓
Que é o tal precipitado branco.
Diminuindo-se substancialmente a concentração dos íons Zn2+, a formação do triiodeto volta a acontecer, retornando, quase tudo, "como dantes no quartel d'Abrantes", retornando a coloração vermelha finalmente.
Última edição por rihan em Qui 08 Set 2016, 17:53, editado 8 vez(es)
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: (Ufal) Pilhas
Re: (Ufal) Pilhas
"O triiodeto é um poderoso redutor e, em assim sendo, se oxida e reduz o íon do zinco, cedendo-lhe elétrons:"
Rihan, o iodo não sofre redução e, portanto, recebe os elétrons do zinco o qual se oxida?
Rihan, o iodo não sofre redução e, portanto, recebe os elétrons do zinco o qual se oxida?

Giovana Martins- Grande Mestre

- Mensagens : 8545
Data de inscrição : 15/05/2015
Idade : 24
Localização : São Paulo
 Re: (Ufal) Pilhas
Re: (Ufal) Pilhas
Valeu pela sua atenção Giovana !
Vou dar uma olhada de novo e tentar reescrever e explicar melhor.
Já notei que você gosta de Química !
Que tal se aprofundar e se apaixonar mais ?
Segue um link especial pra você:
http://www.chemguide.co.uk/index.html#top
Considero essa fonte excelente !
Moderna, didática, inovadora e, principalmente, respeitada mundialmente.
Ótimas reações químicas pra você ! !
!
Vou dar uma olhada de novo e tentar reescrever e explicar melhor.
Já notei que você gosta de Química !
Que tal se aprofundar e se apaixonar mais ?
Segue um link especial pra você:
http://www.chemguide.co.uk/index.html#top
Considero essa fonte excelente !
Moderna, didática, inovadora e, principalmente, respeitada mundialmente.
Ótimas reações químicas pra você !
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: (Ufal) Pilhas
Re: (Ufal) Pilhas
Pronto !
Realmente está errado o que eu escrevi.
Vou corrigir.
Realmente está errado o que eu escrevi.
Vou corrigir.
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: (Ufal) Pilhas
Re: (Ufal) Pilhas
Muito obrigada, Rihan!!!
____________________________________________
Charlotte de Witte - Universal Nation

Giovana Martins- Grande Mestre

- Mensagens : 8545
Data de inscrição : 15/05/2015
Idade : 24
Localização : São Paulo
 Re: (Ufal) Pilhas
Re: (Ufal) Pilhas
Eu que tenho de lhe agradecer !  !
!
Se você for curiosa — e eu acho que é — no link que lhe enviei tem muitos outros excelentes !
Garimpe !
Acostume-se a ler em Inglês.
Se for técnico, fica bem mais fácil.
Vai ser sempre dois ou mais coelhos com uma cajadada só !
Se você for curiosa — e eu acho que é — no link que lhe enviei tem muitos outros excelentes !
Garimpe !
Acostume-se a ler em Inglês.
Se for técnico, fica bem mais fácil.
Vai ser sempre dois ou mais coelhos com uma cajadada só !
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: (Ufal) Pilhas
Re: (Ufal) Pilhas
Com certeza irei tirar proveito do link. Aliás, preciso melhorar no Inglês mesmo. Minhas notas na escola e nos simulados com relação a essa matéria são terríveis  . Tenha um ótimo fim de semana!!
. Tenha um ótimo fim de semana!!
 . Tenha um ótimo fim de semana!!
. Tenha um ótimo fim de semana!!
Giovana Martins- Grande Mestre

- Mensagens : 8545
Data de inscrição : 15/05/2015
Idade : 24
Localização : São Paulo
 Re: (Ufal) Pilhas
Re: (Ufal) Pilhas
Pra você também !
Dica:
O Inglês Técnico é fácil, tem uma quantidade pequena de verbos, quase não há expressões idiomáticas, poucos substantivos e adjetivos, poucas conjunções e preposições, alguns advérbios.
Em suma, o vocabulário é pequeno e característico do AUTOR, que vai geralmente repeti-lo em sua obra, raramente substituindo-os por sinônimos.
Quando for ler qualquer livro ou papper, crie o hábito de, numa folha ou bloquinho a parte, ir escrevendo as palavras novas e seus significados, descobertos em um DICIONÁRIO.
Se você usar TRADUTORES vai ficar preguiçosa...
Quanto mais cedo você começar a fazer isso, mais fácil vai ser. Quanto mais tarde, muito, muito, muito mais difícil...
Acredite sempre em você e na preguiça: ambas existem !
Dica:
O Inglês Técnico é fácil, tem uma quantidade pequena de verbos, quase não há expressões idiomáticas, poucos substantivos e adjetivos, poucas conjunções e preposições, alguns advérbios.
Em suma, o vocabulário é pequeno e característico do AUTOR, que vai geralmente repeti-lo em sua obra, raramente substituindo-os por sinônimos.
Quando for ler qualquer livro ou papper, crie o hábito de, numa folha ou bloquinho a parte, ir escrevendo as palavras novas e seus significados, descobertos em um DICIONÁRIO.
Se você usar TRADUTORES vai ficar preguiçosa...
Quanto mais cedo você começar a fazer isso, mais fácil vai ser. Quanto mais tarde, muito, muito, muito mais difícil...
Acredite sempre em você e na preguiça: ambas existem !
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
Página 1 de 2 • 1, 2 
PiR2 :: Química :: Físico-Química
Página 1 de 2
Permissões neste sub-fórum
Não podes responder a tópicos












