Fósforo
3 participantes
Página 1 de 1
 Fósforo
Fósforo
Por que o Fósforo, na molécula 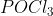 forma cinco ligações? Afinal, ele possui cinco elétrons na camada de valência, então, ele deveria formar apenas três ligações. Nessa molécula ele forma cinco, e, portanto, adquire mais elétrons do que a regra do octeto determina?
forma cinco ligações? Afinal, ele possui cinco elétrons na camada de valência, então, ele deveria formar apenas três ligações. Nessa molécula ele forma cinco, e, portanto, adquire mais elétrons do que a regra do octeto determina?
Isso serve para outras moléculas também, com átomos de elementos que deveriam formar apenas um determinado número de ligações mas formam mais, passando do número de elétrons da regra do octeto.
Seria porque tanto o elemento Oxigênio quanto o Cloro são mais eletronegativos que o Fósforo, e, portanto, ao realizar as ligações covalentes com estes dois elementos ele na verdade "perde" seus elétrons, perdendo, portanto, toda a sua última camada de 5 elétrons? :scratch:
Isso serve para outras moléculas também, com átomos de elementos que deveriam formar apenas um determinado número de ligações mas formam mais, passando do número de elétrons da regra do octeto.
Seria porque tanto o elemento Oxigênio quanto o Cloro são mais eletronegativos que o Fósforo, e, portanto, ao realizar as ligações covalentes com estes dois elementos ele na verdade "perde" seus elétrons, perdendo, portanto, toda a sua última camada de 5 elétrons? :scratch:
 Re: Fósforo
Re: Fósforo
É por conta das hibridações, no caso, o fósforo pode sofrer a hibridação  .
.
 .
.Pela distribuição eletrônica do Fósforo  temos 5 elétrons na camada de valência e pela distribuição dos spins, o subnível "s" terá 2 elétrons emparelhados e no subnível "p" terá 3 elétrons desemparelhados.
temos 5 elétrons na camada de valência e pela distribuição dos spins, o subnível "s" terá 2 elétrons emparelhados e no subnível "p" terá 3 elétrons desemparelhados.
 temos 5 elétrons na camada de valência e pela distribuição dos spins, o subnível "s" terá 2 elétrons emparelhados e no subnível "p" terá 3 elétrons desemparelhados.
temos 5 elétrons na camada de valência e pela distribuição dos spins, o subnível "s" terá 2 elétrons emparelhados e no subnível "p" terá 3 elétrons desemparelhados.Mas, o Fósforo pode realizar algumas ligações, como por exemplo,  , para isso, o Fósforo precisará de 5 elétrons desemparelhados, então o que acontece é a migração de 1 elétron do subnível "s" para o subnível "d", assim teremos os 5 elétrons livres, e o Fósforo com distribuição
, para isso, o Fósforo precisará de 5 elétrons desemparelhados, então o que acontece é a migração de 1 elétron do subnível "s" para o subnível "d", assim teremos os 5 elétrons livres, e o Fósforo com distribuição  .
.
 , para isso, o Fósforo precisará de 5 elétrons desemparelhados, então o que acontece é a migração de 1 elétron do subnível "s" para o subnível "d", assim teremos os 5 elétrons livres, e o Fósforo com distribuição
, para isso, o Fósforo precisará de 5 elétrons desemparelhados, então o que acontece é a migração de 1 elétron do subnível "s" para o subnível "d", assim teremos os 5 elétrons livres, e o Fósforo com distribuição  .
.Não sei se é isso o que acontece no caso que você disse, mas é a minha opinião. 


xSoloDrop- Fera

- Mensagens : 492
Data de inscrição : 23/03/2015
Idade : 26
Localização : Araçatuba SP
 Re: Fósforo
Re: Fósforo
Então, xSoloDrop, eu dei uma boa pesquisada em torno disso. O que eu achei foi que os orbitais 4s e 3d possuem energia muito muito próxima uma da outra, e por isso, elementos do terceiro período podem colocar elétrons a mais na camada de valência, pondo-os diretamente no 3d ao invés de colocar no 4s.
Também não sei se está correto, mas foi o que achei.
Acho que tu não entendeu muito bem a minha pergunta. :scratch:
Sim, é por causa da hibridação que as ligações ocorrem, mas o que eu queria saber é como a camada de valência se estende para mais de 8 elétrons.
Valeu pela contribuição.
Também não sei se está correto, mas foi o que achei.
Acho que tu não entendeu muito bem a minha pergunta. :scratch:
Sim, é por causa da hibridação que as ligações ocorrem, mas o que eu queria saber é como a camada de valência se estende para mais de 8 elétrons.
Valeu pela contribuição.
 Re: Fósforo
Re: Fósforo
Desculpe se eu não respondi sua questão. =P
Basicamente o elemento "ganha" elétrons para completar o subnível que falta.
Enquanto que a configuração inicial do fósforo terminava em 3p³, isso significa que ele precisa "ganhar" mais 3 para atingir 3p^6.
Como na forma de hibridação ele termina em 3d¹, isso implica que ele pode "ganhar" mais elétrons do que a regra do octeto permite, desse modo tornando-se uma excessão.
*Também devemos levar em conta o tamanho do átomo central, como o Ashitaka postou.

xSoloDrop- Fera

- Mensagens : 492
Data de inscrição : 23/03/2015
Idade : 26
Localização : Araçatuba SP
 Tópicos semelhantes
Tópicos semelhantes» Os palitos de fósforo
» Cor e estabilidade - Fósforo
» Ciclo do fósforo
» Ácidos do Fósforo e Arsênio
» Formas alotrópicas do fósforo
» Cor e estabilidade - Fósforo
» Ciclo do fósforo
» Ácidos do Fósforo e Arsênio
» Formas alotrópicas do fósforo
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|
















