Funções inorgânicas(Ácidos e BAses)
2 participantes
Página 1 de 1
 Funções inorgânicas(Ácidos e BAses)
Funções inorgânicas(Ácidos e BAses)
De acordo com as teorias de Arrhenius, Brönsted-Lowry e Lewis, diferentes substâncias podem ser reconhecidas como ácidos ou bases. Assinale a alternativa que apresenta substâncias classificadas como ácidos de acordo com as teorias de Arrhenius, Brönsted-Lowry e Lewis, respectivamente. a) HCℓ, H2SO4, NH3
b) NH3, HCℓ, HCN
c) H2SO4, CN– , NH4 +
d) NaOH, CH3COO– , SO4 2–
e) H2SO4, HCℓ, NH4 +
Duvida: Como NH4+ da letra ''e'' pode ser acido de Lewis ? aonde que pode receber o par de elétrons?
Seria uma menção ao Íon H+(que é efetivamente o acido) que se juntou ao Nh3 para formar o NH4+?
b) NH3, HCℓ, HCN
c) H2SO4, CN– , NH4 +
d) NaOH, CH3COO– , SO4 2–
e) H2SO4, HCℓ, NH4 +
Duvida: Como NH4+ da letra ''e'' pode ser acido de Lewis ? aonde que pode receber o par de elétrons?
Seria uma menção ao Íon H+(que é efetivamente o acido) que se juntou ao Nh3 para formar o NH4+?

nathanvasoncelos958- Jedi

- Mensagens : 252
Data de inscrição : 30/04/2021
Idade : 23
 Re: FUNÇÕES INORGÂNICAS(ÁCIDOS E BASES)
Re: FUNÇÕES INORGÂNICAS(ÁCIDOS E BASES)
Fala, Nathan.
Só para relembrar:
Teoria ácido-base de Arrhenius:
Ácidos em meio aquoso sofrem ionização liberando H+ e as bases sofrem dissociação liberando o OH-.
Teoria ácido-base de Bronsted Lowry:
Ácido é toda substância capaz de doar um próton, base é toda espécie química capaz de receber um próton.
Teoria ácido-base de Lewis:
Ácido é toda espécie química capaz de receber par de elétros, base é toda espécie química capaz de doar par de elétrons.
Visto isso, vamos analisar as alternativas:
a) HCl(aq) -> H+ + Cl- (é ácido de Arrhenius)
H2SO4 + H2O -> HSO4- + H3O+ (é ácido de Bronsted Lowry)
O caso do nitrogênio é importante de comentar, lembre-se que ele possui par de elétrons inerte e, por isso, pode doá-lo em algumas ocasiões:
Um exemplo disso é a reação de trifluoreto de boro com amônia:

Logo essa alternativa está errada.
b) Como já foi visto, NH3 é base. Errada.
c) CN- é base de Bronsted Lowry:
H3O+ + CN- <-> HCN + H2O
(veja que o CN- é a base conjugada do ácido HCN, a base gerada pelo ácido após doar seu próton). Alternativa errada.
d) NaOH(aq) -> Na+ + OH- é base. Errada.
e) Finalmente, chegamos na sua dúvida:
H2SO4(aq) -> H+ + HSO4- (é ácido de Arrhenius)
HCl + H2O -> Cl- + H3O+ (é ácido de Bronsted Lowry)
E o NH4+ é ácido de Lewis. Você poderia ver de dois jeitos:
NH3 + H2O <-> NH4+ + OH- é o ácido conjugado do NH3, portanto como é ácido de Bronsted Lowry, também é ácido de Lewis (OBS: mas nem todo ácido de Lewis é ácido de Bronsted Lowry).
Outra forma de ver é que essa espécie está positiva, portanto sendo capaz de receber par de elétrons, o que é, por definição, ácido de Lewis.
Só para relembrar:
Teoria ácido-base de Arrhenius:
Ácidos em meio aquoso sofrem ionização liberando H+ e as bases sofrem dissociação liberando o OH-.
Teoria ácido-base de Bronsted Lowry:
Ácido é toda substância capaz de doar um próton, base é toda espécie química capaz de receber um próton.
Teoria ácido-base de Lewis:
Ácido é toda espécie química capaz de receber par de elétros, base é toda espécie química capaz de doar par de elétrons.
Visto isso, vamos analisar as alternativas:
a) HCl(aq) -> H+ + Cl- (é ácido de Arrhenius)
H2SO4 + H2O -> HSO4- + H3O+ (é ácido de Bronsted Lowry)
O caso do nitrogênio é importante de comentar, lembre-se que ele possui par de elétrons inerte e, por isso, pode doá-lo em algumas ocasiões:
Um exemplo disso é a reação de trifluoreto de boro com amônia:

Logo essa alternativa está errada.
b) Como já foi visto, NH3 é base. Errada.
c) CN- é base de Bronsted Lowry:
H3O+ + CN- <-> HCN + H2O
(veja que o CN- é a base conjugada do ácido HCN, a base gerada pelo ácido após doar seu próton). Alternativa errada.
d) NaOH(aq) -> Na+ + OH- é base. Errada.
e) Finalmente, chegamos na sua dúvida:
H2SO4(aq) -> H+ + HSO4- (é ácido de Arrhenius)
HCl + H2O -> Cl- + H3O+ (é ácido de Bronsted Lowry)
E o NH4+ é ácido de Lewis. Você poderia ver de dois jeitos:
NH3 + H2O <-> NH4+ + OH- é o ácido conjugado do NH3, portanto como é ácido de Bronsted Lowry, também é ácido de Lewis (OBS: mas nem todo ácido de Lewis é ácido de Bronsted Lowry).
Outra forma de ver é que essa espécie está positiva, portanto sendo capaz de receber par de elétrons, o que é, por definição, ácido de Lewis.
João Pedro Lima- Jedi

- Mensagens : 218
Data de inscrição : 02/01/2022
Idade : 21
Localização : Rio de Janeiro, RJ
nathanvasoncelos958 gosta desta mensagem
 Re: Funções inorgânicas(Ácidos e BAses)
Re: Funções inorgânicas(Ácidos e BAses)
Opa, Desculpa a demora. Obrigado Pela resposta. Surgiu algumas duvidas, agradeceria se responde-se elas .
1°-> se ele pedir para saber se é acido segundo conceito de bronsted lory sem nenhuma equação previa eu simplesmente imagino uma reação com H20? Tenho essa liberdade para testar com H20 igual você fez com HCl?
2° duvida -> ''HCl + H2O -> Cl- + H3O+ (é ácido de Bronsted Lowry)''
O que faz o Acido perder o H do HCl é o fato de água ter o polo negativo(do oxigênio) e o hidrogênio estar positivo por causa do cloro puxando seu elétron né ?
3°-> Minha duvida principal era a respeito do NH4+: quem seria o acido segundo o conceito de lewis seria o H+(íon sozinho) não ? o NH3 doaria o par (base) o H+ receberia o par (acido) formando NH4+. O NH4+ não teria como receber o par de elétrons segundo sua estrutura
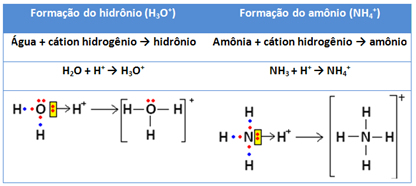
Além disso, porque NH4+ fica como cátion(a estrutura inteira) ? se nele o nitrogênio fica todo estabilizado e o hidrogênio(sem o elétron) fica com os 2 elétrons quando ocorre a dativa(estabilizado também)
Desculpe as varias duvidas, agradeço o tempo!
1°-> se ele pedir para saber se é acido segundo conceito de bronsted lory sem nenhuma equação previa eu simplesmente imagino uma reação com H20? Tenho essa liberdade para testar com H20 igual você fez com HCl?
2° duvida -> ''HCl + H2O -> Cl- + H3O+ (é ácido de Bronsted Lowry)''
O que faz o Acido perder o H do HCl é o fato de água ter o polo negativo(do oxigênio) e o hidrogênio estar positivo por causa do cloro puxando seu elétron né ?
3°-> Minha duvida principal era a respeito do NH4+: quem seria o acido segundo o conceito de lewis seria o H+(íon sozinho) não ? o NH3 doaria o par (base) o H+ receberia o par (acido) formando NH4+. O NH4+ não teria como receber o par de elétrons segundo sua estrutura

Além disso, porque NH4+ fica como cátion(a estrutura inteira) ? se nele o nitrogênio fica todo estabilizado e o hidrogênio(sem o elétron) fica com os 2 elétrons quando ocorre a dativa(estabilizado também)
Desculpe as varias duvidas, agradeço o tempo!

nathanvasoncelos958- Jedi

- Mensagens : 252
Data de inscrição : 30/04/2021
Idade : 23
 Re: Funções inorgânicas(Ácidos e BAses)
Re: Funções inorgânicas(Ácidos e BAses)
Fala, Nathan. Pode mandar quantas dúvidas que tiver, vamos lá:
1) Sim. Primeiro é importante destacar que acidez e basicidade no conceito de Bronsted Lowry dependem do referencial (existem espécies anfóteras, como a água, que podem reagir ora como ácido ora como base), mas o que é mais utilizado são soluções aquosas, por isso sempre me baseio na água. Mas falar que HCl é ácido pois reage com NaOH gerando sal e água também está completamente certo.
Outra questão mais complexa sobre o referencial que eu disse é: já imaginou se reagirmos ácidos fortes com ácidos fracos em soluções sem água? Por exemplo uma mistura de HCl com ácido acético?
Acredito eu que não ocorra uma reação de fato, mas haverá um equilíbrio químico deslocado para a direita:
HCl + H3CCOOH => Cl (-) + H3CCOOH2 (+)
Assim, pode-se dizer que o ácido acético estaria, nesse caso, atuando como uma base. No entanto isso já vai para uma particularidade imensa difícil de ser cobrada. Portanto meu conselho é que se baseie em soluções aquosas. Ademais, não fale que o ácido acético é anfótero.
2) Sim.
3) Sim. Nessa reação que você mostrou o NH3 atua como base e o H+ como ácido. Mas essa reação não se dá de forma direta, há um equilíbrio químico envolvido, lembre-se que o NH3 é base fraca. Olhe esse exemplo no qual AH é um ácido genérico:
NH3 + AH <-> NH4+(ácido conjugado) + A-
(não existem espécies H+ soltas na natureza, reações no formato que você mandou suprimem a base conjugada A-)
Repare que o nitrogênio após doar seu par de elétrons ganha uma carga formal positiva, o que não condiz com sua elevada eletronegatividade. Assim, o quão deslocado está o equilíbrio depende da força ácida do AH, quanto mais forte mais para a direita estará o equilíbrio, quanto mais fraco mais para a esquerda estará o equilíbrio.
Esse []+ na estrutura inteira indica que a espécie está deficiente de elétrons. A conta realizada é essa:
Total de elétrons das camadas de valência: H = 1, N = 5
Como há 4 hidrogênios e 1 nitrogênio: 5 + 4 = 9.
Mas olhando o NH4 vemos:

Contantando as bolinhas vermelhas nós achamos 8, portanto está faltando 1 elétron. Isso é representado pelo + fora dos colchetes.
Foi?
1) Sim. Primeiro é importante destacar que acidez e basicidade no conceito de Bronsted Lowry dependem do referencial (existem espécies anfóteras, como a água, que podem reagir ora como ácido ora como base), mas o que é mais utilizado são soluções aquosas, por isso sempre me baseio na água. Mas falar que HCl é ácido pois reage com NaOH gerando sal e água também está completamente certo.
Outra questão mais complexa sobre o referencial que eu disse é: já imaginou se reagirmos ácidos fortes com ácidos fracos em soluções sem água? Por exemplo uma mistura de HCl com ácido acético?
Acredito eu que não ocorra uma reação de fato, mas haverá um equilíbrio químico deslocado para a direita:
HCl + H3CCOOH => Cl (-) + H3CCOOH2 (+)
Assim, pode-se dizer que o ácido acético estaria, nesse caso, atuando como uma base. No entanto isso já vai para uma particularidade imensa difícil de ser cobrada. Portanto meu conselho é que se baseie em soluções aquosas. Ademais, não fale que o ácido acético é anfótero.
2) Sim.
3) Sim. Nessa reação que você mostrou o NH3 atua como base e o H+ como ácido. Mas essa reação não se dá de forma direta, há um equilíbrio químico envolvido, lembre-se que o NH3 é base fraca. Olhe esse exemplo no qual AH é um ácido genérico:
NH3 + AH <-> NH4+(ácido conjugado) + A-
(não existem espécies H+ soltas na natureza, reações no formato que você mandou suprimem a base conjugada A-)
Repare que o nitrogênio após doar seu par de elétrons ganha uma carga formal positiva, o que não condiz com sua elevada eletronegatividade. Assim, o quão deslocado está o equilíbrio depende da força ácida do AH, quanto mais forte mais para a direita estará o equilíbrio, quanto mais fraco mais para a esquerda estará o equilíbrio.
Esse []+ na estrutura inteira indica que a espécie está deficiente de elétrons. A conta realizada é essa:
Total de elétrons das camadas de valência: H = 1, N = 5
Como há 4 hidrogênios e 1 nitrogênio: 5 + 4 = 9.
Mas olhando o NH4 vemos:

Contantando as bolinhas vermelhas nós achamos 8, portanto está faltando 1 elétron. Isso é representado pelo + fora dos colchetes.
Foi?
João Pedro Lima- Jedi

- Mensagens : 218
Data de inscrição : 02/01/2022
Idade : 21
Localização : Rio de Janeiro, RJ
nathanvasoncelos958 gosta desta mensagem
 Re: Funções inorgânicas(Ácidos e BAses)
Re: Funções inorgânicas(Ácidos e BAses)
Excelente explicação amigo! Fazia tempo que não recebia uma dessas kkkkk.
Última coisa:As bases de lewis tem as mesmas propriedades de arrenius ?(reagem com acido para formar sal + h20)(ph>7, sabor adstringente...) e toda vez que ele pedir acido de lewis eu tenho que basicamente olhar o acido conjugado da 1° base de lewis ?
Última coisa:As bases de lewis tem as mesmas propriedades de arrenius ?(reagem com acido para formar sal + h20)(ph>7, sabor adstringente...) e toda vez que ele pedir acido de lewis eu tenho que basicamente olhar o acido conjugado da 1° base de lewis ?

nathanvasoncelos958- Jedi

- Mensagens : 252
Data de inscrição : 30/04/2021
Idade : 23
João Pedro Lima gosta desta mensagem
 Re: Funções inorgânicas(Ácidos e BAses)
Re: Funções inorgânicas(Ácidos e BAses)
Sem problema, qualquer dúvida só chamar.
Nem todas. A teoria de Lewis adiciona umas bases novas que não estavam presentes na teoria de Arrhenius. Mas toda base de Arrhenius também é base de Lewis.
É um jeito de ver também, no entanto se baseie mais na definição ''ácidos de Lewis recebem par de elétrons'', assim espécies que possuem carga real ou formal positiva, são ácidos de Lewis.
Por exemplo, o AlCl3 é ácido de Lewis?
Repare que o Al está ligado com átomos fortemente eletronegativos, o que desloca a nuvem eletrônica para longe dele, sendo assim possível de receber um par de elétrons, o que é um ácido de Lewis.
Nem todas. A teoria de Lewis adiciona umas bases novas que não estavam presentes na teoria de Arrhenius. Mas toda base de Arrhenius também é base de Lewis.
É um jeito de ver também, no entanto se baseie mais na definição ''ácidos de Lewis recebem par de elétrons'', assim espécies que possuem carga real ou formal positiva, são ácidos de Lewis.
Por exemplo, o AlCl3 é ácido de Lewis?
Repare que o Al está ligado com átomos fortemente eletronegativos, o que desloca a nuvem eletrônica para longe dele, sendo assim possível de receber um par de elétrons, o que é um ácido de Lewis.
João Pedro Lima- Jedi

- Mensagens : 218
Data de inscrição : 02/01/2022
Idade : 21
Localização : Rio de Janeiro, RJ
 Tópicos semelhantes
Tópicos semelhantes» Funções inorgânicas(Ácidos e Bases)
» Funções inorgânicas- bases- UEFS-2016.1
» Ácidos e bases
» Ácidos e Bases
» Ácidos e bases
» Funções inorgânicas- bases- UEFS-2016.1
» Ácidos e bases
» Ácidos e Bases
» Ácidos e bases
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













