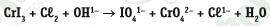balanceamento redox
2 participantes
Página 1 de 1

Hévila Farias- Jedi

- Mensagens : 210
Data de inscrição : 20/11/2015
Idade : 25
Localização : Duque de Caxias, Rio de Janeiro - Brasil
 Re: balanceamento redox
Re: balanceamento redox
Primeiramente, temos que calcular o Nox de cada elemento (vamos desprezar os oxigênios e hidrogênios):
CrI3 + Cl2 + OH- -> IO4^- + CrO4^2- + Cl^- + H2O
No CrI3, o Cr tem Nox +3 e no CrO4^2- o Cr tem Nox +6, então, nessa oxidação, 3 elétrons foram perdidos, certo? O "delta" desse Nox seria, desse modo, 3.
Também no CrI3, mas agora analisando o Iodo, sabemos que o Nox dele é -1, e no IO4^- é +7. Assim, o Iodo também foi oxidado e perdeu 8 elétrons. Mas há 3 Iodos no CrI3, então devemos multiplicar esse delta por 3, de modo que são totalizados 24 elétrons.
No total, houve a perda de 27 elétrons.
Agora, analisando a redução do Cl, vemos que ele possuía Nox igual a 0 no Cl2 e -1 no Cl^-. Assim, houve o ganho de 1 elétron.
Ok, agora o próximo passo é fazer a tal "Regra do X", ou simplesmente a inversão dos "deltas", ou então montar um sistema que vise o balanceamento dos elétrons obtidos e perdidos. Vou fazer do segundo modo, pois nesse exercício achei mais simples desse modo. Vamos lá: podemos separar essa equação em duas reações redox. A reação da redução e a da oxidação, para que possamos facilitar os cálculos. Para isto, vou remover algumas moléculas da nossa equação, apenas para fins didáticos, para que a gente possa analisar as transferências de elétrons de modo mais claro, ok?
Oxidação: CrI3 -> CrO4^2- + IO4^-
Redução: Cl2 -> Cl^-
Agora vamos balancear todos os átomos, exceto o Oxigênio:
Oxid.:
CrI3 -> CrO4^2- + IO4^-
CrI3 -> CrO4^2- + 3 IO4^-
Red.:
Cl2 -> Cl^-
Cl2 -> 2 Cl^-
Beleza, agora vamos acrescentar moléculas de água às nossas reações, a fim de balancear os Oxigênios que estavam fora de proporção.
CrI3 -> CrO4^2- + 3 IO4^-
CrI3 + H2O-> CrO4^2- + 3 IO4^-
CrI3 + 16 H2O-> CrO4^2- + 3 IO4^-
Ainda não está correto. Vamos balancear, agora, os Hidrogênios, acrescentando íons H+.
CrI3 + 16 H2O-> CrO4^2- + 3 IO4^-
CrI3 + 16 H2O-> CrO4^2- + 3 IO4^- + 32 H+
Agora vamos acrescentar hidroxilas OH- aos dois lados da equação para cada íon H+ presente na nossa equação, visando balancear as cargas, e vamos juntar H+ com OH- formando H2O:
CrI3 + 16 H2O + OH- -> CrO4^2- + 3 IO4^- + 32 H+ + OH-
CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H+ + 32 OH-
CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H2O
Finalmente, vamos balancear as cargas. Agora a gente só tem que acrescentar elétrons ao lado mais positivo da nossa equação, visando o equilíbrio de elétrons.
CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H2O
Perceba que temos 32 cargas negativas em excesso no lado esquerdo, e 5 no lado direito. Assim, temos que acrescentar 27 elétrons ao lado direito.
CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H2O + 27 e-'s
Faremos o mesmo com a reação de redução do Cl:
Cl2 + 2 e-'s -> 2 Cl^-
Agora só temos que unir as duas equações de modo que possamos equilibrar os elétrons ganhos e os elétrons perdidos. Faremos isso com um sisteminha:
(CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H2O + 27 e-'s
(Cl2 + 2 e-'s -> 2 Cl^-
Se multiplicarmos o lado de baixo por 27 e o de cima por 2, teremos:
(2 CrI3 + 32 H2O + 64 OH- -> 2 CrO4^2- + 6 IO4^- + 64 H2O +54 e-'s
(27 Cl2 +54 e-'s -> 54 Cl^-
Somando as equações e cancelando os elétrons, temos:
2 CrI3 + 32 H2O + 64 OH + 27 Cl2 -> 2 CrO4^2- + 6 IO4^- + 64 H2O + 54 Cl^-
2 CrI3 + 64 OH + 27 Cl2 -> 2 CrO4^2- + 6 IO4^- + 32 H2O + 54 Cl^-
Terminamos! Tudo está balanceado.
CrI3 + Cl2 + OH- -> IO4^- + CrO4^2- + Cl^- + H2O
No CrI3, o Cr tem Nox +3 e no CrO4^2- o Cr tem Nox +6, então, nessa oxidação, 3 elétrons foram perdidos, certo? O "delta" desse Nox seria, desse modo, 3.
Também no CrI3, mas agora analisando o Iodo, sabemos que o Nox dele é -1, e no IO4^- é +7. Assim, o Iodo também foi oxidado e perdeu 8 elétrons. Mas há 3 Iodos no CrI3, então devemos multiplicar esse delta por 3, de modo que são totalizados 24 elétrons.
No total, houve a perda de 27 elétrons.
Agora, analisando a redução do Cl, vemos que ele possuía Nox igual a 0 no Cl2 e -1 no Cl^-. Assim, houve o ganho de 1 elétron.
Ok, agora o próximo passo é fazer a tal "Regra do X", ou simplesmente a inversão dos "deltas", ou então montar um sistema que vise o balanceamento dos elétrons obtidos e perdidos. Vou fazer do segundo modo, pois nesse exercício achei mais simples desse modo. Vamos lá: podemos separar essa equação em duas reações redox. A reação da redução e a da oxidação, para que possamos facilitar os cálculos. Para isto, vou remover algumas moléculas da nossa equação, apenas para fins didáticos, para que a gente possa analisar as transferências de elétrons de modo mais claro, ok?
Oxidação: CrI3 -> CrO4^2- + IO4^-
Redução: Cl2 -> Cl^-
Agora vamos balancear todos os átomos, exceto o Oxigênio:
Oxid.:
CrI3 -> CrO4^2- + IO4^-
CrI3 -> CrO4^2- + 3 IO4^-
Red.:
Cl2 -> Cl^-
Cl2 -> 2 Cl^-
Beleza, agora vamos acrescentar moléculas de água às nossas reações, a fim de balancear os Oxigênios que estavam fora de proporção.
CrI3 -> CrO4^2- + 3 IO4^-
CrI3 + H2O-> CrO4^2- + 3 IO4^-
CrI3 + 16 H2O-> CrO4^2- + 3 IO4^-
Ainda não está correto. Vamos balancear, agora, os Hidrogênios, acrescentando íons H+.
CrI3 + 16 H2O-> CrO4^2- + 3 IO4^-
CrI3 + 16 H2O-> CrO4^2- + 3 IO4^- + 32 H+
Agora vamos acrescentar hidroxilas OH- aos dois lados da equação para cada íon H+ presente na nossa equação, visando balancear as cargas, e vamos juntar H+ com OH- formando H2O:
CrI3 + 16 H2O + OH- -> CrO4^2- + 3 IO4^- + 32 H+ + OH-
CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H+ + 32 OH-
CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H2O
Finalmente, vamos balancear as cargas. Agora a gente só tem que acrescentar elétrons ao lado mais positivo da nossa equação, visando o equilíbrio de elétrons.
CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H2O
Perceba que temos 32 cargas negativas em excesso no lado esquerdo, e 5 no lado direito. Assim, temos que acrescentar 27 elétrons ao lado direito.
CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H2O + 27 e-'s
Faremos o mesmo com a reação de redução do Cl:
Cl2 + 2 e-'s -> 2 Cl^-
Agora só temos que unir as duas equações de modo que possamos equilibrar os elétrons ganhos e os elétrons perdidos. Faremos isso com um sisteminha:
(CrI3 + 16 H2O + 32 OH- -> CrO4^2- + 3 IO4^- + 32 H2O + 27 e-'s
(Cl2 + 2 e-'s -> 2 Cl^-
Se multiplicarmos o lado de baixo por 27 e o de cima por 2, teremos:
(2 CrI3 + 32 H2O + 64 OH- -> 2 CrO4^2- + 6 IO4^- + 64 H2O +
(27 Cl2 +
Somando as equações e cancelando os elétrons, temos:
2 CrI3 + 32 H2O + 64 OH + 27 Cl2 -> 2 CrO4^2- + 6 IO4^- + 64 H2O + 54 Cl^-
2 CrI3 + 64 OH + 27 Cl2 -> 2 CrO4^2- + 6 IO4^- + 32 H2O + 54 Cl^-
Terminamos! Tudo está balanceado.
Marceloqa- Iniciante
- Mensagens : 15
Data de inscrição : 23/06/2015
Idade : 29
Localização : São Paulo
 Re: balanceamento redox
Re: balanceamento redox
Obrigada!!!

Hévila Farias- Jedi

- Mensagens : 210
Data de inscrição : 20/11/2015
Idade : 25
Localização : Duque de Caxias, Rio de Janeiro - Brasil
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|