Fórmula Empírica - Quimica Geral Brady
2 participantes
Página 1 de 1
 Fórmula Empírica - Quimica Geral Brady
Fórmula Empírica - Quimica Geral Brady
Uma amostra de 1,35 g de uma substância contendo carbono, hidrogênio, nitrogênio e oxigênio foi queimada e produziu 0,810 g de  e 1,32 g de
e 1,32 g de 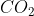 . Em uma reação separada, todo o nitrogênio contido em 0,735 g da substância
. Em uma reação separada, todo o nitrogênio contido em 0,735 g da substância
produziu 0,284 g de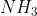 .
.
Determine a fórmula empírica da substância.
Essa questão tem tanto número feio que me confundiu.
produziu 0,284 g de
Determine a fórmula empírica da substância.
Essa questão tem tanto número feio que me confundiu.
- Resposta:
- CH3NO

renan2014- Jedi

- Mensagens : 211
Data de inscrição : 04/07/2015
Localização : Rio de Janeiro
 Re: Fórmula Empírica - Quimica Geral Brady
Re: Fórmula Empírica - Quimica Geral Brady
renan2014 escreveu:Uma amostra de 1,35 g de uma substância contendo carbono, hidrogênio, nitrogênio e oxigênio foi queimada e produziu 0,810 g dee 1,32 g de
. Em uma reação separada, todo o nitrogênio contido em 0,735 g da substância
produziu 0,284 g de.
Determine a fórmula empírica da substância.
Essa questão tem tanto número feio que me confundiu.
- Resposta:
Renan, essa questão deve ser feito passo a passo.
Primeiro vamos fazer a reação na qual a substância foi queimada (combustão)
Sabemos que na combustão, todo carbono da molécula forma o gás carbônico e todo o hidrogênio forma água.
Logo, temos que:
CxHyNO + O2 ----> X CO2 + Y H2O
Bom, sabemos que o numero de mol pode ser calculado pela seguinte fórmula: Número de mols = Massa/Massa molar
Para o gás carbônico temos: X = 1,32/44 = 0,03 Mol de carbono ( pois todo carbono forma o gás carbônico)
Para a água temos: Y/2 = 0,810/18 = 0,09 Mol de hidrogênio ( pois todo hidrogênio forma água e dividimos o Y por 2, porque cada água possui 2 átomos de hidrogênio)
Pronto, agora vamos ver as proporções para a reação que produziu amônia:
Teremos todo o nitrogênio formando 0,284g de amônia
Massa molar da amônia(NH3) = 17g
Numero de mol de nitrogênio = 0,284/17 = 0,0167 mol de nitrogênio
Entretanto, essa proporção seria para 0,735g dessas substância que queremos achar a fórmula. O enunciado nos deu que foi queimado 1,35g dessa substância. Logo, faremos uma regra de três simples:
0,735g da substância ----- 0,0167 mol de nitrogênio
1,35g da substância ---- Z
Z = 0,03 mol de nitrogênio
Então, até agora temos:
0,03 mol de carbono
0,09 mol de hidrogênio
0,03 mol de nitrogênio
precisamos achar o numero de mols de oxigênio, para isso vamos subtrair da massa que foi queimada
1,35g = massa de carbono + massa de hidrogenio + massa de nitrogenio + massa de oxigenio
massa de carbono = 0,03 x 12
massa de hidrogênio = 0,09 x 1
massa de nitrogênio = 0,03 x 14
massa de oxigênio = K
fazendo os cálculos, teremos que:
1,35 = 0,36 + 0,09 + 0,42 + k
k = 0,48g de oxigênio
numero de mols de oxigênio = 0,48 / 16 = 0,03 mol de oxigênio
então temos que:
0,03 mol de carbono
0,09 mol de hidrogênio
0,03 mol de nitrogênio
0,03 mol de oxigênio
PARA O CÁLCULO DA FÓRMULA EMPÍRICA, TEMOS QUE DIVIDIR O NUMERO DE MOLS DE CADA ELEMENTO PELO MENOR VALOR NUMÉRICO, NO CASO 0,03.
Carbono = 0,03/0,03 = 1 mol
Hidrogênio = 0,09/0,03 = 3 mol
Nitrogênio = 0,03/0,03 = 1 mol
Oxigênio = 0,03/0,03 = 1 mol
Logo, temos:
CH3NO

Carlos Augusto Parente- Recebeu o sabre de luz

- Mensagens : 137
Data de inscrição : 09/04/2017
Idade : 28
Localização : Niteroi, Rio de Janeiro, Brasil
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













