Estrutura e carga formal
Página 1 de 1
 Estrutura e carga formal
Estrutura e carga formal
Para fazer a estrutura de uma molécula eu vejo que a melhor fórmula é utilizando da contagem total de elétrons e depois a disposição desses elétrons nos átomos, como eu fiz nesse tópico:
https://pir2.forumeiros.com/t154811-duvida-sobre-estrutura-molecular-pcl4-e-pcl6
Contudo, sabendo que não são todos os elementos que obedecem a regra do octeto, algumas passagens de elétrons são necessárias para que todos os átomos fiquem estáveis. E para isso utilizo a carga formal, que é calculada por:
Carga formal = número de elétrons na camada de valência - elétrons não compartilhados - elétrons compartilhados/2
Minha dúvida:
Ao fazer a fórmula do (PO4)-3, por exemplo, dispõe-se os elétrons e aparentemente é visto que todos os átomos estão com 8 elétrons:
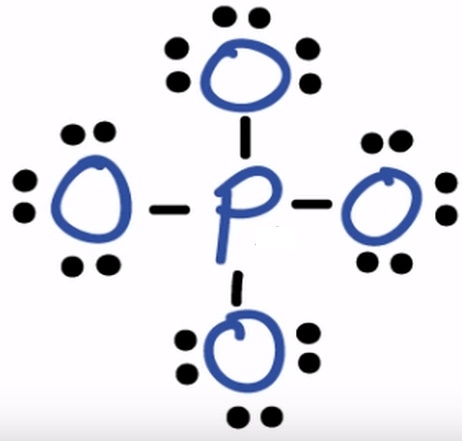
Mas ao calcular a carga formal do fósforo: 5 elétrons na camada de valência - 0 elétrons sendo compartilhados - 8/2 elétrons compartilhados = 1, mostra que a carga formal não está zero e daí necessita de mais um par de elétrons compartilhados (o fósforo tem o chamado octeto expandido)
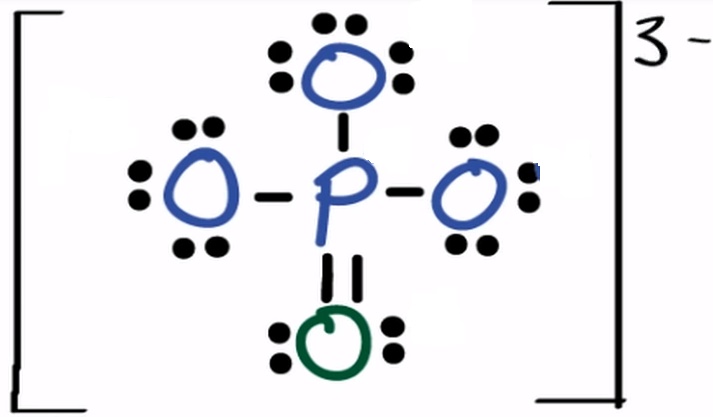
Dessa forma, o fósforo fica com a carga formal zero, estável (5 elétrons na camada de valência - 0 elétrons não compartilhados - 10/2 elétrons compartilhados = 0).
E essa estrutura está correta conforme as bancas de vestibulares que achei.
CONTUDO...
Ao utilizar exatamente a mesma teoria para o SO2 por exemplo, verifica-se que são 18 elétrons, e ao dispor os elétrons enxerga-se que um dos oxigênios necessita compartilhar um par de elétrons com o enxofre, para que ele também fique com 8 elétrons na camada de valência. Mas ao calcular a carga formal, encontra-se 1. Para deixar a carga formal igual a 0, seria necessário que o outro oxigênio também compartilhasse um par de elétrons com o enxofre - o que é certo porque o enxofre também tem o octeto expandido igual ao fósforo. E encontraria então a carga formal igual 0, resultando nessa estrutura: O = S = O.
O problema é que não é considerado a carga formal nas bancas de vestibulares que achei, resultando em O - S = O
Quando devo ou não considerar a carga formal? Se você não considera carga formal, qual é o modo que você pensa sobre esse assunto?
https://pir2.forumeiros.com/t154811-duvida-sobre-estrutura-molecular-pcl4-e-pcl6
Contudo, sabendo que não são todos os elementos que obedecem a regra do octeto, algumas passagens de elétrons são necessárias para que todos os átomos fiquem estáveis. E para isso utilizo a carga formal, que é calculada por:
Carga formal = número de elétrons na camada de valência - elétrons não compartilhados - elétrons compartilhados/2
Minha dúvida:
Ao fazer a fórmula do (PO4)-3, por exemplo, dispõe-se os elétrons e aparentemente é visto que todos os átomos estão com 8 elétrons:

Mas ao calcular a carga formal do fósforo: 5 elétrons na camada de valência - 0 elétrons sendo compartilhados - 8/2 elétrons compartilhados = 1, mostra que a carga formal não está zero e daí necessita de mais um par de elétrons compartilhados (o fósforo tem o chamado octeto expandido)

Dessa forma, o fósforo fica com a carga formal zero, estável (5 elétrons na camada de valência - 0 elétrons não compartilhados - 10/2 elétrons compartilhados = 0).
E essa estrutura está correta conforme as bancas de vestibulares que achei.
CONTUDO...
Ao utilizar exatamente a mesma teoria para o SO2 por exemplo, verifica-se que são 18 elétrons, e ao dispor os elétrons enxerga-se que um dos oxigênios necessita compartilhar um par de elétrons com o enxofre, para que ele também fique com 8 elétrons na camada de valência. Mas ao calcular a carga formal, encontra-se 1. Para deixar a carga formal igual a 0, seria necessário que o outro oxigênio também compartilhasse um par de elétrons com o enxofre - o que é certo porque o enxofre também tem o octeto expandido igual ao fósforo. E encontraria então a carga formal igual 0, resultando nessa estrutura: O = S = O.
O problema é que não é considerado a carga formal nas bancas de vestibulares que achei, resultando em O - S = O
Quando devo ou não considerar a carga formal? Se você não considera carga formal, qual é o modo que você pensa sobre esse assunto?

Carol Peletier- Padawan

- Mensagens : 73
Data de inscrição : 27/04/2016
Idade : 26
Localização : RJ - RJ - Brasil
 Re: Estrutura e carga formal
Re: Estrutura e carga formal
Melhorando minha pergunta:
A diferença é a carga de cada átomo.
Em O-S=O:
- Carga do oxigênio 1 = 0
- Carga do enxofre = 1
- Carga do oxigênio 2 = -1
Total = 0
Em O=S=O
- Carga do oxigênio 1 = 0
- Carga do enxofre = 0
- Carga do oxigênio 2 = 0
E na teoria não só a carga total deve estar próxima de 0 (sem ser um íon) como também a carga formal de cada átomo, o que torna teoricamente a segunda estrutura mais correta.
Mas experimentalmente descobriram que o que acontece é mais próximo da primeira estrutura, embora não ocorra nenhuma das duas exatamente porque há um efeito de ressonância e na verdade forma-se uma nuvem de elétrons.
Então, a dúvida seria o que botar em uma prova discursiva caso caia, a geometria correta na teoria ou a correta na prática.
A diferença é a carga de cada átomo.
Em O-S=O:
- Carga do oxigênio 1 = 0
- Carga do enxofre = 1
- Carga do oxigênio 2 = -1
Total = 0
Em O=S=O
- Carga do oxigênio 1 = 0
- Carga do enxofre = 0
- Carga do oxigênio 2 = 0
E na teoria não só a carga total deve estar próxima de 0 (sem ser um íon) como também a carga formal de cada átomo, o que torna teoricamente a segunda estrutura mais correta.
Mas experimentalmente descobriram que o que acontece é mais próximo da primeira estrutura, embora não ocorra nenhuma das duas exatamente porque há um efeito de ressonância e na verdade forma-se uma nuvem de elétrons.
Então, a dúvida seria o que botar em uma prova discursiva caso caia, a geometria correta na teoria ou a correta na prática.

Carol Peletier- Padawan

- Mensagens : 73
Data de inscrição : 27/04/2016
Idade : 26
Localização : RJ - RJ - Brasil
 Tópicos semelhantes
Tópicos semelhantes» Carga Formal
» Carga Formal
» Dúvida - Carga Formal
» Definição formal de Limites
» Definição formal de limite
» Carga Formal
» Dúvida - Carga Formal
» Definição formal de Limites
» Definição formal de limite
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













