Eletroquímica - Eletrólise Ígnea
3 participantes
Página 1 de 1
 Eletroquímica - Eletrólise Ígnea
Eletroquímica - Eletrólise Ígnea
Possivelmente, o cobre foi o primeiro metal usado pelo homem. Acredita-se que, por volta
de 13 000 a.C., tenha sido encontrado na superfície da Terra em forma de “cobre nativo”, o metal
puro em seu estado metálico. Usado inicialmente para substituir a pedra como ferramenta de trabalho
e na confecção de armas e de objetos de decoração, o cobre tornou-se, pelas suas propriedades,
uma descoberta fundamental na história da civilização humana.
(www.eletrica.ufpr.br. Adaptado.)
O cobre na indústria é obtido por processo eletrolítico a partir do cobre impuro. Na figura é representada
uma cuba eletrolítica contendo duas placas metálicas, uma de cobre puro e outra de cobre
impuro, mergulhadas em solução aquosa de CuSO4.
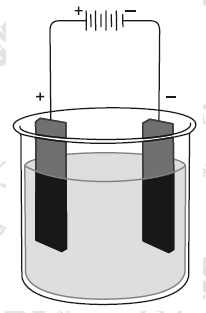
a) Qual das placas representadas na figura corresponde ao cobre impuro? Justifique.
b) Escreva as equações das reações químicas que ocorrem no cátodo e no ânodo, considerando somente
as espécies de cobre.
Gente, alguém pode me explicar o motivo de, na letra A, o cobre que está no polo positivo ser oxidado? Eu pensava que haveria a oxidação dos íons SO4-2 no polo positivo...
de 13 000 a.C., tenha sido encontrado na superfície da Terra em forma de “cobre nativo”, o metal
puro em seu estado metálico. Usado inicialmente para substituir a pedra como ferramenta de trabalho
e na confecção de armas e de objetos de decoração, o cobre tornou-se, pelas suas propriedades,
uma descoberta fundamental na história da civilização humana.
(www.eletrica.ufpr.br. Adaptado.)
O cobre na indústria é obtido por processo eletrolítico a partir do cobre impuro. Na figura é representada
uma cuba eletrolítica contendo duas placas metálicas, uma de cobre puro e outra de cobre
impuro, mergulhadas em solução aquosa de CuSO4.

a) Qual das placas representadas na figura corresponde ao cobre impuro? Justifique.
b) Escreva as equações das reações químicas que ocorrem no cátodo e no ânodo, considerando somente
as espécies de cobre.
Gente, alguém pode me explicar o motivo de, na letra A, o cobre que está no polo positivo ser oxidado? Eu pensava que haveria a oxidação dos íons SO4-2 no polo positivo...
- Spoiler:
- a) A placa que corresponde ao cobre impuro
é o ânodo (positiva), ou seja, a placa da
esquerda. Nesta placa ocorre oxidação do
cobre e sua massa diminui com a liberação
de cátions Cu2+ para a solução e de
elétrons para o fio ligado ao gerador.
Os cátions Cu2+ sofrem redução na placa
negativa (cátodo) e o cobre é recuperado.
Os elétrons se movem da placa positiva
(ânodo) para a placa negativa (cátodo).
O cobre é transferido do ânodo para o cátodo,
onde o cobre puro se acumula, as
impurezas ficam na solução.
b) Reações químicas que ocorrem no cátodo
e no ânodo, considerando somente as espécies
de cobre:
Cátodo:
Cu2+
(aq) + 2e- → Cu(s) (redução do íon Cu2+)
Ânodo:
Cu(s) → Cu2+
(aq) + 2e- (oxidação do cobre)
brunamarc- Recebeu o sabre de luz

- Mensagens : 197
Data de inscrição : 09/10/2019
Idade : 24
Localização : Rio de Janeiro, RJ. Brasil.
 Re: Eletroquímica - Eletrólise Ígnea
Re: Eletroquímica - Eletrólise Ígnea
É fundamental ter em mente que, mesmo que a questão só mencione dados do sal, há duas coisas que sempre ocorrem em soluções aquosas de sais sob eletrólise: a eletrólise do próprio sal, e a eletrólise da água. Os íons da água irão "brigar" com os íons do sal nos polos negativo e positivo; quem tiver o maior potencial padrão de redução (E) para a respectiva reação de oxidação (ou redução) - e se o produto da reação for estável - ganha.
Então, quais são esses íons no caso de uma solução de CuSO4?
Temos os íons Cu2+ e H+ sendo reduzidos (recebendo elétrons) no polo negativo, aos quais são atraídos:
Cu2+ + 2e- --> Cu, E=0.34
2H+ + 2e- --> H2, E=0 (por definição).
Como o potencial do redução dos íons Cu2+ é maior que os dos íons H+, o cobre é reduzido em vez do hidrogênio.
No polo positivo, teremos os íons OH- e SO4(2-) sendo atraídos (enquanto o cobre está sendo oxidado pela corrente elétrica). Temos as seguintes reações:
SO4(2-) --> SO4 + 2e-
4OH- --> O2 + 2H2O + 4e-, E=-0.4.
Observe que mesmo que o sulfato seja oxidado, o resultado é um radical que poderá reagir com a água, ou com ele mesmo produzindo S2O8 (peróxido de dissulfato). Por isso, consideramos somente a oxidação da hidroxila, que produz gás oxigênio.
E é isso que de fato ocorre quando você purifica uma placa de cobre: no cátodo ocorre a deposição de íons Cu2+ e, no ânodo, ocorre ambas a oxidação do próprio cobre e da água: https://www.youtube.com/watch?v=RFk7U0zyZsg
Então, quais são esses íons no caso de uma solução de CuSO4?
Temos os íons Cu2+ e H+ sendo reduzidos (recebendo elétrons) no polo negativo, aos quais são atraídos:
Cu2+ + 2e- --> Cu, E=0.34
2H+ + 2e- --> H2, E=0 (por definição).
Como o potencial do redução dos íons Cu2+ é maior que os dos íons H+, o cobre é reduzido em vez do hidrogênio.
No polo positivo, teremos os íons OH- e SO4(2-) sendo atraídos (enquanto o cobre está sendo oxidado pela corrente elétrica). Temos as seguintes reações:
SO4(2-) --> SO4 + 2e-
4OH- --> O2 + 2H2O + 4e-, E=-0.4.
Observe que mesmo que o sulfato seja oxidado, o resultado é um radical que poderá reagir com a água, ou com ele mesmo produzindo S2O8 (peróxido de dissulfato). Por isso, consideramos somente a oxidação da hidroxila, que produz gás oxigênio.
E é isso que de fato ocorre quando você purifica uma placa de cobre: no cátodo ocorre a deposição de íons Cu2+ e, no ânodo, ocorre ambas a oxidação do próprio cobre e da água: https://www.youtube.com/watch?v=RFk7U0zyZsg
anathemaoftruth- Iniciante
- Mensagens : 14
Data de inscrição : 16/06/2020
Idade : 22
Localização : Arapiraca, Alagoas.
 Re: Eletroquímica - Eletrólise Ígnea
Re: Eletroquímica - Eletrólise Ígnea
Outra coisa: isso não é eletrólise ígnea - que significa a eletrólise de sais em estado líquido (que usualmente requer elevadas temperaturas, por isso "ígnea"). Isso é somente uma reação de eletrólise de solução aquosa.
anathemaoftruth- Iniciante
- Mensagens : 14
Data de inscrição : 16/06/2020
Idade : 22
Localização : Arapiraca, Alagoas.
 Re: Eletroquímica - Eletrólise Ígnea
Re: Eletroquímica - Eletrólise Ígnea
Alguém poderia me explicar o porquê da placa esquerda ser o cobre impuro?

Zeroberto- Jedi

- Mensagens : 374
Data de inscrição : 14/12/2022
Idade : 19
Localização : Jaguariaíva - PR
 Tópicos semelhantes
Tópicos semelhantes» eletroquimica/ eletrolise ignea + estequiomet
» Eletrólise Ígnea
» Eletrólise ígnea
» Eletrólise ígnea
» PUC-SP eletrólise ígnea ou aquosa
» Eletrólise Ígnea
» Eletrólise ígnea
» Eletrólise ígnea
» PUC-SP eletrólise ígnea ou aquosa
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













