Equilíbrio químico
3 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Equilíbrio químico
Equilíbrio químico
(Ufc 2000) A formação da casca dos ovos das aves é, geralmente, proveniente da reação:
[latex]Ca^{2+} (aq) + CO_{3}^{2-} (aq) \Leftrightarrow CaCO_{3} (s) [/latex]
Os íons [latex] CO_{3}^{2-} [/latex] são naturalmente produzidos, a partir do metabolismo do [latex] CO_{2}[/latex] e do [latex]Ca^{+}[/latex] , que são convertidos em [latex]H_{2}CO_{3} [/latex] , enzimaticamente, originando os seguintes equilíbrios:
[latex]CO_{2} (g) + H_{2}O (l) \Leftrightarrow H_{2}CO_{3} (aq)[/latex]
[latex]H_{2}CO_{3} (aq) \Leftrightarrow H^{+} + HCO_{3} ^{-} (aq) [/latex]
[latex]HCO_{3} ^{-} (aq) \Leftrightarrow H^{+} + CO_{3}^{2-} (aq)[/latex]
Como as aves não transpiram, faz-se necessária uma intensa respiração para resfriar seus próprios corpos, acarretando na grande liberação de [latex] CO_{2}[/latex] e, conseqüentemente, na deficiência de íons [latex] CO_{3}^{2-} [/latex]comprometendo a formação da casca dos ovos. De acordo com o princípio de Le Chatelier, assinale a alternativa que contempla a melhoria do processo de formação da casca dos ovos das aves.
a) Adição de ácido clorídrico à água fornecida às aves.
b) Adição de monóxido de carbono, CO, à água fornecida às aves.
c) Adição de carbonato de sódio, [latex]Na_{2}CO_{3} [/latex] , , à água fornecida às aves.
d) Fornecer água destilada às aves.
e) Fornecer soro caseiro (açúcar e sal de cozinha) às aves.
Olá! A minha dúvida é que, se houver a adição do carbonato de sódio, este irá de dissociar, formando o Na2+ e [latex] CO_{3}^{2-}[/latex] , isso não causará o deslocamento a favor do HCO3-, ao contrário do que a questão quer?
Outra dúvida é o porquê da D está errada, se o aumento de água deslocará a primeira reação para o H2CO3, favorecendo as reações em cadeia e aumentando a quantidade do íon.
[latex]Ca^{2+} (aq) + CO_{3}^{2-} (aq) \Leftrightarrow CaCO_{3} (s) [/latex]
Os íons [latex] CO_{3}^{2-} [/latex] são naturalmente produzidos, a partir do metabolismo do [latex] CO_{2}[/latex] e do [latex]Ca^{+}[/latex] , que são convertidos em [latex]H_{2}CO_{3} [/latex] , enzimaticamente, originando os seguintes equilíbrios:
[latex]CO_{2} (g) + H_{2}O (l) \Leftrightarrow H_{2}CO_{3} (aq)[/latex]
[latex]H_{2}CO_{3} (aq) \Leftrightarrow H^{+} + HCO_{3} ^{-} (aq) [/latex]
[latex]HCO_{3} ^{-} (aq) \Leftrightarrow H^{+} + CO_{3}^{2-} (aq)[/latex]
Como as aves não transpiram, faz-se necessária uma intensa respiração para resfriar seus próprios corpos, acarretando na grande liberação de [latex] CO_{2}[/latex] e, conseqüentemente, na deficiência de íons [latex] CO_{3}^{2-} [/latex]comprometendo a formação da casca dos ovos. De acordo com o princípio de Le Chatelier, assinale a alternativa que contempla a melhoria do processo de formação da casca dos ovos das aves.
a) Adição de ácido clorídrico à água fornecida às aves.
b) Adição de monóxido de carbono, CO, à água fornecida às aves.
c) Adição de carbonato de sódio, [latex]Na_{2}CO_{3} [/latex] , , à água fornecida às aves.
d) Fornecer água destilada às aves.
e) Fornecer soro caseiro (açúcar e sal de cozinha) às aves.
- Gabarito:
- C
Olá! A minha dúvida é que, se houver a adição do carbonato de sódio, este irá de dissociar, formando o Na2+ e [latex] CO_{3}^{2-}[/latex] , isso não causará o deslocamento a favor do HCO3-, ao contrário do que a questão quer?
Outra dúvida é o porquê da D está errada, se o aumento de água deslocará a primeira reação para o H2CO3, favorecendo as reações em cadeia e aumentando a quantidade do íon.
Última edição por fernandalnh em Dom 14 Mar 2021, 16:27, editado 1 vez(es)

fernandalnh- Recebeu o sabre de luz

- Mensagens : 132
Data de inscrição : 02/02/2021
Idade : 21
Localização : Macapá, AP
 Re: Equilíbrio químico
Re: Equilíbrio químico
Reação global:

"A minha dúvida é, se houver a adição do carbonato de sódio, este se dissociará, formando o Na2+ e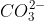 , isto não causará o deslocamento a favor do HCO3-, ao contrário do que a questão quer?"
, isto não causará o deslocamento a favor do HCO3-, ao contrário do que a questão quer?"
Pela teoria de pearson, como o H+ é mais duro que o Ca2+, a reação que mais ocorrerá será a que forma o H2CO3. Se não conhecer a teoria de pearson (não recomendo que pesquise na internet, pode lhe confundir, no JD LEE é bem explicado), teria que saber que a relação carga/raio do H+ é maior que a do Ca2+.
"Outra dúvida é o porquê da D estar errada, se o aumento de água deslocará a primeira reação para o H2CO3, favorecendo as reações em cadeia e aumentando a quantidade do íon."
A ave irá continuar bebendo a mesma quantidade de água, independente de ser destilada ou não, assim, não haverá diferença entre a concentração da água no meio. Logo, em tese, não ocorrerá perturbação no equilíbrio.
Acredito que esta foi a ideia que o autor da questão teve. Ao meu ver um pouco forçada.
"A minha dúvida é, se houver a adição do carbonato de sódio, este se dissociará, formando o Na2+ e
Pela teoria de pearson, como o H+ é mais duro que o Ca2+, a reação que mais ocorrerá será a que forma o H2CO3. Se não conhecer a teoria de pearson (não recomendo que pesquise na internet, pode lhe confundir, no JD LEE é bem explicado), teria que saber que a relação carga/raio do H+ é maior que a do Ca2+.
"Outra dúvida é o porquê da D estar errada, se o aumento de água deslocará a primeira reação para o H2CO3, favorecendo as reações em cadeia e aumentando a quantidade do íon."
A ave irá continuar bebendo a mesma quantidade de água, independente de ser destilada ou não, assim, não haverá diferença entre a concentração da água no meio. Logo, em tese, não ocorrerá perturbação no equilíbrio.
Acredito que esta foi a ideia que o autor da questão teve. Ao meu ver um pouco forçada.

Eduardo Rabelo- Fera

- Mensagens : 638
Data de inscrição : 23/06/2020
Idade : 19
Localização : Curitiba
 Re: Equilíbrio químico
Re: Equilíbrio químico
Obrigada, Eduardo! Consegui entender o erro da D, mas ainda estou emperrada na C: se a reação que passará a ocorrer mais é a segunda da cadeia e o motivo dela ocorrer é o aumento de HCO3- (então o sentido será favorecido para a esquerda), isso não irá contra o sentido da terceira reação? Outra coisa, por que podemos afirmar que o desiquilíbrio causado pela interação entre H+ e o íon carbonato impactará na segunda cadeia, e não na terceira?

fernandalnh- Recebeu o sabre de luz

- Mensagens : 132
Data de inscrição : 02/02/2021
Idade : 21
Localização : Macapá, AP
 Re: Equilíbrio químico
Re: Equilíbrio químico
"se a reação que passará a ocorrer mais é a segunda da cadeia e o motivo dela ocorrer é o aumento de HCO3- (então o sentido será favorecido para a esquerda), isso não irá contra o sentido da terceira reação? "
Na verdade, a reação que mais ocorre é a reação de hidrólise do Na2CO3, veja:

O NaHCO3 forma:

Logo:

E assim pertubando o equilíbrio da forma desejada.
obs: A 1ª justificativa que mostrei seria a provavelmente usada por um professor de ensino médio, por isso utilizei, mas esta é a mais correta.
"Outra coisa, por que podemos afirmar que o desiquilíbrio causado pela interação entre H+ e o íon carbonato impactará na segunda cadeia, e não na terceira?"
Isso não pode ser afirmado, na verdade, as duas reações (2 e 3) ocorrem praticamente ao mesmo tempo, tanto que podem ser simplificadas assim:

Pensando na 1ª justificativa, no momento que o H+ reagir com o íon carbonato oriundo do carbonato de sódio, a concentração de H+ diminuiria, tendendo o equilíbrio para formação de CO3(2-).
Na verdade, a reação que mais ocorre é a reação de hidrólise do Na2CO3, veja:
O NaHCO3 forma:
Logo:
E assim pertubando o equilíbrio da forma desejada.
obs: A 1ª justificativa que mostrei seria a provavelmente usada por um professor de ensino médio, por isso utilizei, mas esta é a mais correta.
"Outra coisa, por que podemos afirmar que o desiquilíbrio causado pela interação entre H+ e o íon carbonato impactará na segunda cadeia, e não na terceira?"
Isso não pode ser afirmado, na verdade, as duas reações (2 e 3) ocorrem praticamente ao mesmo tempo, tanto que podem ser simplificadas assim:
Pensando na 1ª justificativa, no momento que o H+ reagir com o íon carbonato oriundo do carbonato de sódio, a concentração de H+ diminuiria, tendendo o equilíbrio para formação de CO3(2-).

Eduardo Rabelo- Fera

- Mensagens : 638
Data de inscrição : 23/06/2020
Idade : 19
Localização : Curitiba
 Re: Equilíbrio químico
Re: Equilíbrio químico
Olá fernanda,
A adição de [latex]Na_{2}CO_{3}[/latex] vai introduzir mais [latex]CO_{3}^{-2}[/latex] no meio, como existe o equilíbrio entre [latex]CO_{3}^{-2}[/latex] e [latex]HCO_{3}^{-}[/latex] ambos os íons vão aumentar em quantidade.
O [latex]CO_{3}^{-2}[/latex] aumenta pela adição do carbonato de sódio
E o [latex]HCO_{3}^{-1}[/latex] aumenta pela reação de equilíbrio.
Vale lembrar que o equilíbrio nem sempre é equivalente, por exemplo: quando as quantidades do íon 1 é duas vezes o do íon 2 as quantidades param de se alterar. Quando você adicionar o carbonato no meio ele não vai ser consumido completamente para formar o íon bicarbonato, o que ocorre é que ambas as quantidades vão aumentar.
No caso da adição de água do item D) não ocorre alteração, isso porque a água é um reagente que está em uma proporção muito maior que os outros, ou seja: adicionar mais não fará diferença, não alterando o equilíbrio da reação.
A adição de [latex]Na_{2}CO_{3}[/latex] vai introduzir mais [latex]CO_{3}^{-2}[/latex] no meio, como existe o equilíbrio entre [latex]CO_{3}^{-2}[/latex] e [latex]HCO_{3}^{-}[/latex] ambos os íons vão aumentar em quantidade.
O [latex]CO_{3}^{-2}[/latex] aumenta pela adição do carbonato de sódio
E o [latex]HCO_{3}^{-1}[/latex] aumenta pela reação de equilíbrio.
Vale lembrar que o equilíbrio nem sempre é equivalente, por exemplo: quando as quantidades do íon 1 é duas vezes o do íon 2 as quantidades param de se alterar. Quando você adicionar o carbonato no meio ele não vai ser consumido completamente para formar o íon bicarbonato, o que ocorre é que ambas as quantidades vão aumentar.
No caso da adição de água do item D) não ocorre alteração, isso porque a água é um reagente que está em uma proporção muito maior que os outros, ou seja: adicionar mais não fará diferença, não alterando o equilíbrio da reação.

PudimdeLimao- Iniciante
- Mensagens : 11
Data de inscrição : 13/02/2021
Eduardo Rabelo gosta desta mensagem
 Re: Equilíbrio químico
Re: Equilíbrio químico
Poxa, agora ficou bem esclarecido. Obrigada pela ajuda, gente  )
)

fernandalnh- Recebeu o sabre de luz

- Mensagens : 132
Data de inscrição : 02/02/2021
Idade : 21
Localização : Macapá, AP
PudimdeLimao gosta desta mensagem
 Tópicos semelhantes
Tópicos semelhantes» Equilíbrio químico - grau de equilíbrio
» PH - EQUILIBRIO QUIMICO.
» equilibrio quimico
» EQUILÍBRIO QUÍMICO
» Equilíbrio químico 2
» PH - EQUILIBRIO QUIMICO.
» equilibrio quimico
» EQUILÍBRIO QUÍMICO
» Equilíbrio químico 2
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













