( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
5 participantes
Página 1 de 1
 ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
( Unifesp ) Com base nos dados da tabela

Pode-se estimar que o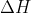 da reação representada por
da reação representada por
\,\,\rightarrow\,\, 2H_2(g)\,\,+\,\,O_2(g))
dado em kJ por mol de) , é igual a:
, é igual a:
a) +239
b) +478
c) +1101
d) -239
e) -478
Gabarito: Letra A
Pessoal fiz a questão e não compreendi muito bem, pois pela variação seria os reagentes pelo produto que é as duas moléculas de água, ai peguei a equação e dividi por 2 e o resultado deu certo mas só quando faço a variação da Energia média de Ligação da água pela a dos produtos.
Pessoal me ajudem, pois não compreendi muito bem a questão !
Agradeço desde já.

Pode-se estimar que o
dado em kJ por mol de
a) +239
b) +478
c) +1101
d) -239
e) -478
Gabarito: Letra A
Pessoal fiz a questão e não compreendi muito bem, pois pela variação seria os reagentes pelo produto que é as duas moléculas de água, ai peguei a equação e dividi por 2 e o resultado deu certo mas só quando faço a variação da Energia média de Ligação da água pela a dos produtos.
Pessoal me ajudem, pois não compreendi muito bem a questão !
Agradeço desde já.

alissonsep- Grupo
Velhos amigos do Fórum
- Mensagens : 1523
Data de inscrição : 21/10/2010
Idade : 32
 Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
A variação da entalpia representa a diferença das entalpias dos produtos e as dos reagentes:
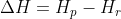
Para a água ----> H---O---H -----> 2*460 = 920
Para a H2 ---> H----H ----> 436
Para O2 -----> O = O ----> 490
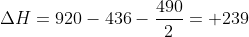
Para a água ----> H---O---H -----> 2*460 = 920
Para a H2 ---> H----H ----> 436
Para O2 -----> O = O ----> 490

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
amigo obrigado !
Então quer dizer q a água nessa reação é o produto, pois pensei q como a seta estava indicando pro hidrogênio e oxigênio eles fossem os produtos...
Então nessa reação a água absorveu calor ( energia ) para quebrar suas ligações e formar os reagentes ?
Agradeço mais uma vez.
Então quer dizer q a água nessa reação é o produto, pois pensei q como a seta estava indicando pro hidrogênio e oxigênio eles fossem os produtos...
Então nessa reação a água absorveu calor ( energia ) para quebrar suas ligações e formar os reagentes ?
Agradeço mais uma vez.

alissonsep- Grupo
Velhos amigos do Fórum
- Mensagens : 1523
Data de inscrição : 21/10/2010
Idade : 32
 Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Então nessa reação a água absorveu calor ( energia ) para quebrar suas ligações e formar os reagentes ?
Sim
Quebra de ligação ---> Reação endotérmica
Sim
Quebra de ligação ---> Reação endotérmica

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
só tenho mais uma dúvida: Pq a água esta como produto se a seta indica para o outro lado... ? ela não deveria ser o reagente ?

alissonsep- Grupo
Velhos amigos do Fórum
- Mensagens : 1523
Data de inscrição : 21/10/2010
Idade : 32
 Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Utilidade das energias de ligação
De posse dos valores de energias de ligação, podemos calcular a variação da entalpia para uma reação, em fase gasosa, dividindo-a teoricamente em uma etapa de quebra de ligações e outra formação de ligações.
Primeiramente calculamos a quantidade de energia para quebrar as ligações. Essa primeira etapa é endotérmica, isto é, apresenta :
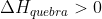 .
.
A seguir, calculamos a quantidade de energia necessária para formar as ligações. Essa segunda etapa é exotérmica, ou seja, tem:
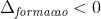
O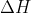 da reação global corresponde à soma algébrica:
da reação global corresponde à soma algébrica:
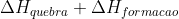
Para o nosso caso:
Primeiro dividimos a equação por 2, já que queremos 1mol de água:
H2O(g) ---> H2(g) + 1/2*O2(g)
Variação da entalpia de quebra : H---O---H
2*460=920 (endotérmica)
Variação da entalpia de formação : H---H + 1/2* (O=O)
436+490/2 = -681 (exotérmica)
A variação da entalpia da reação global será:
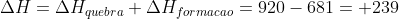
OBS: A parte que explica passo a passo eu retirei de uma apostila
De posse dos valores de energias de ligação, podemos calcular a variação da entalpia para uma reação, em fase gasosa, dividindo-a teoricamente em uma etapa de quebra de ligações e outra formação de ligações.
Primeiramente calculamos a quantidade de energia para quebrar as ligações. Essa primeira etapa é endotérmica, isto é, apresenta :
A seguir, calculamos a quantidade de energia necessária para formar as ligações. Essa segunda etapa é exotérmica, ou seja, tem:
O
Para o nosso caso:
Primeiro dividimos a equação por 2, já que queremos 1mol de água:
H2O(g) ---> H2(g) + 1/2*O2(g)
Variação da entalpia de quebra : H---O---H
2*460=920 (endotérmica)
Variação da entalpia de formação : H---H + 1/2* (O=O)
436+490/2 = -681 (exotérmica)
A variação da entalpia da reação global será:
OBS: A parte que explica passo a passo eu retirei de uma apostila

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Sensacional agradeço bastante, pois havia pensado que a variação da entalpia da reação fosse o deltaH dos produtos - o deltaH dos reagentes, mas agora percebi q não é !!
Obrigado mais uma vez...
Obrigado mais uma vez...

alissonsep- Grupo
Velhos amigos do Fórum
- Mensagens : 1523
Data de inscrição : 21/10/2010
Idade : 32
 Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
explicação maravilhosa. Parabéns!!

<Mourão>- Recebeu o sabre de luz

- Mensagens : 194
Data de inscrição : 04/06/2011
Idade : 34
Localização : Rio de Janeiro
 Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
To tentando resolver essa mesma questão, mas to com um problema:
2 mol de H2O -----> 2 mol de H2 + 1 mol de O2
H---O---H H---H O==O
H---O---H H---H
Logo, são 4 ligações O--H : 1840KJ
2 ligações H--H : -872KJ
1 ligação O=O : -490KJ
ΔH: +472KJ
O que está errado?
valeu!
2 mol de H2O -----> 2 mol de H2 + 1 mol de O2
H---O---H H---H O==O
H---O---H H---H
Logo, são 4 ligações O--H : 1840KJ
2 ligações H--H : -872KJ
1 ligação O=O : -490KJ
ΔH: +472KJ
O que está errado?
valeu!
lucasfavarin- Padawan

- Mensagens : 74
Data de inscrição : 24/02/2016
Idade : 29
Localização : SC
 Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
Re: ( Unifesp ) Variação de Entalpia dada pela Energia média de Ligação...
lucasfavarin escreveu:To tentando resolver essa mesma questão, mas to com um problema:
2 mol de H2O -----> 2 mol de H2 + 1 mol de O2
H---O---H H---H O==O
H---O---H H---H
Logo, são 4 ligações O--H : 1840KJ
2 ligações H--H : -872KJ
1 ligação O=O : -490KJ
ΔH: +472KJ
O que está errado?
valeu!
Esse valor é para 2 mols de H2O.
nicallopes- Iniciante
- Mensagens : 2
Data de inscrição : 07/01/2017
Idade : 31
Localização : Brasília
 Tópicos semelhantes
Tópicos semelhantes» Energia de ligacao e variacao de entalpia.
» Energia de ligação e variação da entalpia numa reação
» Calcule a energia de ligação média H-O na molécula de água
» Entalpia de formaçao x Entalpia ligaçao
» Escreva o conjunto expresso pela propriedade dada:
» Energia de ligação e variação da entalpia numa reação
» Calcule a energia de ligação média H-O na molécula de água
» Entalpia de formaçao x Entalpia ligaçao
» Escreva o conjunto expresso pela propriedade dada:
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












