Será?! Ou !?
3 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Será?! Ou !?
Será?! Ou !?
Estava estudando e diante desse tanto de equacao em físico quimica falando de equilibro, resolvi fazer um mexido e deu algo muito estranho.
Temos a equacao de arrhenius :
K=Ae^-Ea/RT
e a relação entre energia livre de gibbs e quociente de reação (que quando,em equilíbrio ) temos:
/\G=-RTlnK
Considere /\G o DELTA G(tô no cel ).
Da segunda equação tiramos que
K=e^-/\G/RT
Iguala as duas...
Ae^-Ea/RT=e^-/\G/RT
[size=33]Daí,tira o natural pra simplificar,tendo:[/size]
[size=33]lnA-Ea/RT=-/\G/RT[/size]
[size=33]Contudo,pode se considerar a entalpia (em muitos casos)como a energia necessaria para formar o complexo ativado.Também deltaG=deltaG -TdeltaS [/size]
[size=34]lnA - deltaH/RT=-(deltaH -TdeltaS)/RT[/size]
[size=34]Assim,aparece...............[/size]
[size=34]DeltaS=lnA [/size]
[size=35]O que essa fórmula quer dizer ?[/size]
[size=35]Esse A geralmente não é muito explicado (só ocupa espaço ) ,visto que em problemas ele é fornecido.Teria alguma relação com a variação da entropia? [/size]
[size=35]Desde já ,agradeço pela ajuda! [/size]
Temos a equacao de arrhenius :
K=Ae^-Ea/RT
e a relação entre energia livre de gibbs e quociente de reação (que quando,em equilíbrio ) temos:
/\G=-RTlnK
Considere /\G o DELTA G(tô no cel ).
Da segunda equação tiramos que
K=e^-/\G/RT
Iguala as duas...
Ae^-Ea/RT=e^-/\G/RT
[size=33]Daí,tira o natural pra simplificar,tendo:[/size]
[size=33]lnA-Ea/RT=-/\G/RT[/size]
[size=33]Contudo,pode se considerar a entalpia (em muitos casos)como a energia necessaria para formar o complexo ativado.Também deltaG=deltaG -TdeltaS [/size]
[size=34]lnA - deltaH/RT=-(deltaH -TdeltaS)/RT[/size]
[size=34]Assim,aparece...............[/size]
[size=34]DeltaS=lnA [/size]
[size=35]O que essa fórmula quer dizer ?[/size]
[size=35]Esse A geralmente não é muito explicado (só ocupa espaço ) ,visto que em problemas ele é fornecido.Teria alguma relação com a variação da entropia? [/size]
[size=35]Desde já ,agradeço pela ajuda! [/size]
OXYNEW- Jedi

- Mensagens : 232
Data de inscrição : 05/03/2016
Idade : 23
Localização : Ipatinga,MG
 Re: Será?! Ou !?
Re: Será?! Ou !?
Mas tem um detalhe, o k da equação de Arrhenius corresponde à constante de velocidade da reação, não à constante de equilíbrio. Portanto não se pode igualar as duas equações como você fez...
André Meneses- Recebeu o sabre de luz

- Mensagens : 174
Data de inscrição : 12/07/2016
Idade : 23
Localização : Natal - RN
 Re: Será?! Ou !?
Re: Será?! Ou !?
Vlw,e tanto k que deixa a gente Konfuso
OXYNEW- Jedi

- Mensagens : 232
Data de inscrição : 05/03/2016
Idade : 23
Localização : Ipatinga,MG
 Re: Será?! Ou !?
Re: Será?! Ou !?
Estava vendo esse tópico e senti uma vontade de corroborar comigo do passado...é legal ver que evolui !
Pra começar...vamos falar da eq. de Arrhenius:
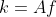
Como o amigo acima disse,k é uma constante de velocidade(não façam como eu!).Já o f é obtido por meio de cálculos estatísticos (originário do modelo de Distribuição de Maxwell-Boltzmann) e está relacionado ao número de móleculas possuindo valor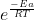 ,logo,
,logo,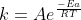 .Em relação ao A(geralmente eles te dão no problema ou falam que ele cte para a reação direta e inversa,logo,dá pra cortar ),contudo,gostaria que não confundissem (como fiz) e não relacionassem com entropia kkk.
.Em relação ao A(geralmente eles te dão no problema ou falam que ele cte para a reação direta e inversa,logo,dá pra cortar ),contudo,gostaria que não confundissem (como fiz) e não relacionassem com entropia kkk.
Assim,vamos conceituar o A!O A é chamado de constante de Arrhenius ou fator pré-exponencial(corresponde a cte de proporcionalidade entre as concentrações dos reagentes e a velocidade com que as moleculas reagentes colidem ).A expressão dele é meio estranha (mas por ambito de curiosidade):
^{\frac{1}{2}}.N_{A}^{2})
Obs:essa expressão é de acordo com a Teoria Cinética dos Gases
ONDE:
k é a cte de Boltzmann
T é a temperatura na qual a reação ocorre(em condições padrão é 298,15 K)
PI e PI !
N a é o número de Avogadro
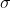 é a seção eficaz da colisão (corresponde a área da colisão que uma molecula disponibiliza para outra molecula)
é a seção eficaz da colisão (corresponde a área da colisão que uma molecula disponibiliza para outra molecula)
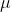 é a massa reduzida da molecula dos reagentes(geralmente ela é utilizada na mecanica newtoniana mas é presente na Química).
é a massa reduzida da molecula dos reagentes(geralmente ela é utilizada na mecanica newtoniana mas é presente na Química).
Ex:(MAIS UMA EQUAÇÃO QUE RELACIONA A SOMA DO INVERSO !!)
Para uma molecula de HCl,sua massa reduzida(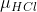 ) é :
) é :
 ,logo(desenvolvendo a expressão)
,logo(desenvolvendo a expressão) 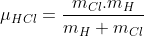
Essa Eq. de Arrhenius pode ser utilizada para descobrir o valor da cte de velocidade de uma reação em diferentes temperaturas.Para isso,voce precisa desenvolve-la :
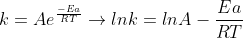
Assim,supondo que voce possua o valor de uma cte de velocidade k1 a uma temperatura T1 e queira achar o valor da cte de velocidade a uma temperatura T2,temos:
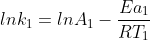 (1)
(1)
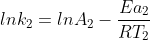 (2)
(2)
Subtraindo (1)- (2)
)
Com isso,consideramos que o fator pré exponencial da reação inversa e direta sejam iguais e que a energia de ativação é cte,obtendo:
=\frac{Ea}{R}(\frac{1}{T_{2}}-\frac{1}{T_{1}}))
ou
})
OBS: só lembrando que e é o número de euler
Com essa expressão é possivel chegar ao valor da energia de ativação ,T1 ou T2 ,K1 ou k2 (enfim...vai depender do que o problema vai lhe exigir).Geralmente dá 3 das 4 incógnitas ou um gráfico bonitinho.
Também há outras equações semelhantes :
Equação de Clausius-Clayperon
=\frac{\Delta&space;H_{vap}}{R}(\frac{1}{T_{2}}-\frac{1}{T_{1}}))
(a dedução dela envolve cálculo por isso não colocarei-haja mão ! mas é só digitar no google)
OBS: perceba que é log e não logaritmo natural !
Também há a expressão:
Chamada de equação de Vant Hoff(isocórica de Van't Hoff-não confunda com o fator i de Van´t Hoff)
=\frac{\Delta&space;H_{r}}{R}(\frac{1}{T_{2}}-\frac{1}{T_{1}}))
obs: nesse caso sim é a cte de equílibrio
Para desenvolve-la basta usar a expressão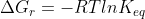 (mesma coisa de
(mesma coisa de 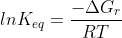 )
)
utilizando o fato que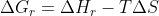 e desenvolver isso semelhante ao que fiz acima.
e desenvolver isso semelhante ao que fiz acima.
AGORA VAMOS A QUESTÃO (o que pensei no tópico)
Imagine um equílibrio:
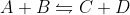 em que a cte de velocidade da reação direta é
em que a cte de velocidade da reação direta é 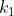 e da inversa seja
e da inversa seja 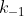 .Logo,pelo conceito de cte de equilibrio ,temos:
.Logo,pelo conceito de cte de equilibrio ,temos:
![\frac{k_{1}}{k_{-1}}=K_{eq}=\frac{[C][D]}{[A][B]}](https://latex.codecogs.com/gif.latex?\frac{k_{1}}{k_{-1}}=K_{eq}=\frac{[C][D]}{[A][B]}) .Pela expressão que disse anteriormente,obtemos
.Pela expressão que disse anteriormente,obtemos 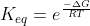 .Assim,igualando ambas expressões...:
.Assim,igualando ambas expressões...:
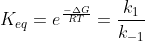
Dessa forma,podemos abrir essas ctes de velocidade:
.e^{\frac{-Ea_{1}}{RT_{1}}-(\frac{-Ea_{-1}}{RT_{-1}})}) .Considerando a energia de ativação como cte obtém-se
.Considerando a energia de ativação como cte obtém-se .e^{\frac{Ea}{R}.(\frac{1}{_{T_{-1}}}-\frac{1}{T_{1}})})
.Também se (como sempre!) considerarmos o fator pré-exponencial como igual para a direta e inversa temos:}) ,com isso, obteríamos:
,com isso, obteríamos:}) .
.
MAS PERCEBAM O PROBLEMA !
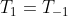 pois o sistema,estandoem equilibrio possui uma temperatura cte independentemente da direção da reação,deixando o termo entre parenteses nulo.RESUMO: O QUE HAVIA PENSADO ERA INTERESSANTE,MAS NÃO DEU CERTO !
pois o sistema,estandoem equilibrio possui uma temperatura cte independentemente da direção da reação,deixando o termo entre parenteses nulo.RESUMO: O QUE HAVIA PENSADO ERA INTERESSANTE,MAS NÃO DEU CERTO !
Enfim...já estou muito feliz por nesse período ter conseguido aprender isso e poder retribuir um pouco a resposta dada ao OXYNEW do passado kk !
Pra começar...vamos falar da eq. de Arrhenius:
Como o amigo acima disse,k é uma constante de velocidade(não façam como eu!).Já o f é obtido por meio de cálculos estatísticos (originário do modelo de Distribuição de Maxwell-Boltzmann) e está relacionado ao número de móleculas possuindo valor
Assim,vamos conceituar o A!O A é chamado de constante de Arrhenius ou fator pré-exponencial(corresponde a cte de proporcionalidade entre as concentrações dos reagentes e a velocidade com que as moleculas reagentes colidem ).A expressão dele é meio estranha (mas por ambito de curiosidade):
Obs:essa expressão é de acordo com a Teoria Cinética dos Gases
ONDE:
k é a cte de Boltzmann
T é a temperatura na qual a reação ocorre(em condições padrão é 298,15 K)
PI e PI !
N a é o número de Avogadro
Ex:(MAIS UMA EQUAÇÃO QUE RELACIONA A SOMA DO INVERSO !!)
Para uma molecula de HCl,sua massa reduzida(
Essa Eq. de Arrhenius pode ser utilizada para descobrir o valor da cte de velocidade de uma reação em diferentes temperaturas.Para isso,voce precisa desenvolve-la :
Assim,supondo que voce possua o valor de uma cte de velocidade k1 a uma temperatura T1 e queira achar o valor da cte de velocidade a uma temperatura T2,temos:
Subtraindo (1)- (2)
Com isso,consideramos que o fator pré exponencial da reação inversa e direta sejam iguais e que a energia de ativação é cte,obtendo:
ou
OBS: só lembrando que e é o número de euler
Com essa expressão é possivel chegar ao valor da energia de ativação ,T1 ou T2 ,K1 ou k2 (enfim...vai depender do que o problema vai lhe exigir).Geralmente dá 3 das 4 incógnitas ou um gráfico bonitinho.
Também há outras equações semelhantes :
Equação de Clausius-Clayperon
(a dedução dela envolve cálculo por isso não colocarei-haja mão ! mas é só digitar no google)
OBS: perceba que é log e não logaritmo natural !
Também há a expressão:
Chamada de equação de Vant Hoff(isocórica de Van't Hoff-não confunda com o fator i de Van´t Hoff)
obs: nesse caso sim é a cte de equílibrio
Para desenvolve-la basta usar a expressão
utilizando o fato que
AGORA VAMOS A QUESTÃO (o que pensei no tópico)
Imagine um equílibrio:
Dessa forma,podemos abrir essas ctes de velocidade:
.Também se (como sempre!) considerarmos o fator pré-exponencial como igual para a direta e inversa temos:
MAS PERCEBAM O PROBLEMA !
Enfim...já estou muito feliz por nesse período ter conseguido aprender isso e poder retribuir um pouco a resposta dada ao OXYNEW do passado kk !
OXYNEW- Jedi

- Mensagens : 232
Data de inscrição : 05/03/2016
Idade : 23
Localização : Ipatinga,MG
 Re: Será?! Ou !?
Re: Será?! Ou !?
Muito boa a contribuição numa questão de Química. Eu nunca tinha imaginado o uso nesta matéria.

Elcioschin- Grande Mestre

- Mensagens : 73164
Data de inscrição : 15/09/2009
Idade : 78
Localização : Santos/SP
 Tópicos semelhantes
Tópicos semelhantes» Trabalho e Energia
» Será MMC?
» Será que existe ?
» a diferença MB-MA será:
» Será que é meu destino ?
» Será MMC?
» Será que existe ?
» a diferença MB-MA será:
» Será que é meu destino ?
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












