(FMABC - 2014) Termoquímica
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 (FMABC - 2014) Termoquímica
(FMABC - 2014) Termoquímica
A energia envolvida na reação de isomerização do cis but-2-eno para o trans but-2-eno na ausência de catalisador está representada no gráfico a seguir.
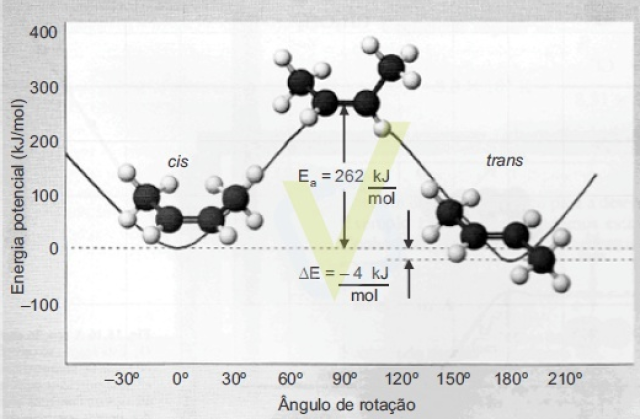
Um estudante ao analisar esse gráfico fez as seguintes afirmações:
I. A 500 ºC a velocidade da reação de isomerização será maior do que a 100 °C.
II. A conversão do isômero cis but-2-eno para o trans but-2-eno é um processo endotérmico.
III. Essa reação de isomerização é lenta devido à alta energia de ativação necessária para romper uma das ligações da dupla entre os carbonos, permitindo que ocorra a rotação da ligação.
IV. Um catalisador eficiente para essa reação deve diminuir a entalpia do isômero trans but-2-eno, tornando a transformação mais favorável.
Estão corretas somente as afirmações:
a) I e II.
b) II e III.
c) III e IV.
d) I e III.
e) II e IV.
Resposta: Letra d

Um estudante ao analisar esse gráfico fez as seguintes afirmações:
I. A 500 ºC a velocidade da reação de isomerização será maior do que a 100 °C.
II. A conversão do isômero cis but-2-eno para o trans but-2-eno é um processo endotérmico.
III. Essa reação de isomerização é lenta devido à alta energia de ativação necessária para romper uma das ligações da dupla entre os carbonos, permitindo que ocorra a rotação da ligação.
IV. Um catalisador eficiente para essa reação deve diminuir a entalpia do isômero trans but-2-eno, tornando a transformação mais favorável.
Estão corretas somente as afirmações:
a) I e II.
b) II e III.
c) III e IV.
d) I e III.
e) II e IV.
Resposta: Letra d
stefanyscastro- Padawan

- Mensagens : 98
Data de inscrição : 02/07/2015
Idade : 27
Localização : Gama, Distrito Federal, Brasil
 Re: (FMABC - 2014) Termoquímica
Re: (FMABC - 2014) Termoquímica
Oi, Stefany. Vamos analisar essa questão aí.
I. Verdadeira. Pelo estudo da cinética química, sabemos que qualquer reação ocorrerá mais rápido se a temperatura for aumentada, pois dessa forma a velocidade com as quais os átomos se locomovem é maior, e, portanto, a probabilidade de ocorrerem colisões efetivas a ponto de formarem o complexo ativado e realizarem a reação é maior.
II. Falsa. Pela análise do gráfico de termoquímica apresentado, podemos ver que a reação é exotérmica, uma vez que há a liberação de 4 kJ por mol de cis but-2-eno transformado em trans but-2-eno.
III. Verdadeira. Pelo conhecimento da teoria dos isômeros de química orgânica, sabemos que complexos com ligações duplas não podem se rotacionar, sem que essa ligação dupla seja quebrada e transformada em simples. Pelo conhecimento da termoquímica, por sua vez, sabemos que a quebra de uma ligação requer fornecimento de energia, e quanto mais forte for a ligação, mais energia de ativação será necessária (é por isso que a reação é lenta). Contudo, ela não deixa de ser exotérmica, pois a ligação, ao fim, é retomada, e a realização de ligações é exotérmica.
IV. Falsa. Pelo estudo da cinética química e da termoquímica sabemos que os catalisadores não influenciam em nada SE NÃO na velocidade da reação.
Espero ter lhe ajudado!
I. Verdadeira. Pelo estudo da cinética química, sabemos que qualquer reação ocorrerá mais rápido se a temperatura for aumentada, pois dessa forma a velocidade com as quais os átomos se locomovem é maior, e, portanto, a probabilidade de ocorrerem colisões efetivas a ponto de formarem o complexo ativado e realizarem a reação é maior.
II. Falsa. Pela análise do gráfico de termoquímica apresentado, podemos ver que a reação é exotérmica, uma vez que há a liberação de 4 kJ por mol de cis but-2-eno transformado em trans but-2-eno.
III. Verdadeira. Pelo conhecimento da teoria dos isômeros de química orgânica, sabemos que complexos com ligações duplas não podem se rotacionar, sem que essa ligação dupla seja quebrada e transformada em simples. Pelo conhecimento da termoquímica, por sua vez, sabemos que a quebra de uma ligação requer fornecimento de energia, e quanto mais forte for a ligação, mais energia de ativação será necessária (é por isso que a reação é lenta). Contudo, ela não deixa de ser exotérmica, pois a ligação, ao fim, é retomada, e a realização de ligações é exotérmica.
IV. Falsa. Pelo estudo da cinética química e da termoquímica sabemos que os catalisadores não influenciam em nada SE NÃO na velocidade da reação.
Espero ter lhe ajudado!
 Re: (FMABC - 2014) Termoquímica
Re: (FMABC - 2014) Termoquímica
Muito obrigada 
stefanyscastro- Padawan

- Mensagens : 98
Data de inscrição : 02/07/2015
Idade : 27
Localização : Gama, Distrito Federal, Brasil
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|














