Concentração
2 participantes
Página 1 de 1
 Concentração
Concentração
O ácido clorídrico, HCl, é muito usado para dissolver compostos de magnésio, como representado nas equações abaixo.
Mg(OH)2(s) + 2HCl(aq) → MgCl2(aq) + 2H2O(l)
MgCO3(s) + 2HCl(aq) → MgCl2 (aq)+ H2O(l) + CO2(g)
a) Calcule a concentração, em mol L-1, de uma solução aquosa contendo 26% de HCl, em massa, e densidade igual a 1,15 g mL-1.
b) Calcule o volume, em mL, de uma solução aquosa de HCl 0,128 mol L-1 necessário para reagir completamente com 2,87 g de hidróxido de magnésio, Mg(OH)2.
c) Calcule a quantidade máxima, em massa, de MgCl2, quando 0,420 mol de carbonato de magnésio, MgCO3, reage com excesso de HCl. Calcule o rendimento percentual desta reação sabendo que foram produzidos 30,0 g de cloreto de magnésio, MgCl2.
d) Calcule a quantidade, em gramas, de HCl necessária para reagir completamente com 387 g de uma amostra, contendo, em massa, 32,8% de MgCO3 e 67,2% de Mg(OH)2 . Considere rendimento teórico (100%).
Dados:
M(HCl) = 36,46 g mol-1
M(Mg(OH)2) = 58,3 g mol-1
M(MgCl2) = 95,21 g mol-1
M(MgCO3) = 84,3 g mol-1
Gabarito:
a) 8,2 mol L-1
b) 769 mL
c) 40,0g e 75,0%
d) 435,3 g
Gostaria de ajuda nesta questão que contém 4 itens. Minhas respostas não batem com o gabarito.
Obrigado.
Mg(OH)2(s) + 2HCl(aq) → MgCl2(aq) + 2H2O(l)
MgCO3(s) + 2HCl(aq) → MgCl2 (aq)+ H2O(l) + CO2(g)
a) Calcule a concentração, em mol L-1, de uma solução aquosa contendo 26% de HCl, em massa, e densidade igual a 1,15 g mL-1.
b) Calcule o volume, em mL, de uma solução aquosa de HCl 0,128 mol L-1 necessário para reagir completamente com 2,87 g de hidróxido de magnésio, Mg(OH)2.
c) Calcule a quantidade máxima, em massa, de MgCl2, quando 0,420 mol de carbonato de magnésio, MgCO3, reage com excesso de HCl. Calcule o rendimento percentual desta reação sabendo que foram produzidos 30,0 g de cloreto de magnésio, MgCl2.
d) Calcule a quantidade, em gramas, de HCl necessária para reagir completamente com 387 g de uma amostra, contendo, em massa, 32,8% de MgCO3 e 67,2% de Mg(OH)2 . Considere rendimento teórico (100%).
Dados:
M(HCl) = 36,46 g mol-1
M(Mg(OH)2) = 58,3 g mol-1
M(MgCl2) = 95,21 g mol-1
M(MgCO3) = 84,3 g mol-1
Gabarito:
a) 8,2 mol L-1
b) 769 mL
c) 40,0g e 75,0%
d) 435,3 g
Gostaria de ajuda nesta questão que contém 4 itens. Minhas respostas não batem com o gabarito.
Obrigado.

vzz- Jedi

- Mensagens : 336
Data de inscrição : 16/02/2013
Localização : Rio de Janeiro, Rio de Janeiro, Brasil
 Re: Concentração
Re: Concentração
A) Calcule a concentração, em mol L-1, de uma solução aquosa contendo 26% de HCl, em massa, e densidade igual a 1,15 g mL-1.
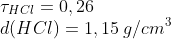
d = C/T --> 1,15 g/cm³ = C/0,26 --> C = 0,299 g/cm³ = 299 g/L
Dado M(HCl) = 36,5 g/mol
[HCl] = C/M = (299 g/L)/ (36,5 g/mol) = 8,192 ≈ 8,2 mol/L
B) Calcule o volume, em mL, de uma solução aquosa de HCl 0,128 mol L-1 necessário para reagir completamente com 2,87 g de hidróxido de magnésio, Mg(OH)2.
2HCl + Mg(OH)2 --> MgCl2 + 2 H2O
Proporção estequiométrica
Dado: M(Mg(OH)2) = 58 g/mol
2 mol HCl -------- 1 mol Mg(OH)2
2.(36,5) g HCl ------ 58 g
m ------------------ 2,87 g
m = 3,6 g de HCl
[HCl] = n/V --> V = n / [HCl]
n = m/M(HCl)
V = m/ (M(HCl).[HCl]) ≈ 770 mL
C) Calcule a quantidade máxima, em massa, de MgCl2, quando 0,420 mol de carbonato de magnésio, MgCO3, reage com excesso de HCl. Calcule o rendimento percentual desta reação sabendo que foram produzidos 30,0 g de cloreto de magnésio, MgCl2.
Dado: M (MgCl2) = 95 g/mol
Reação:
MgCO3(s) + 2HCl(aq) → MgCl2 (aq)+ H2O(l) + CO2(g)
1 mol ---------------- 95 g
0,42 mol -------------- m
m = 39,9 g de MgCl2 ≈ 40 g de MgCL2
Rendimento da reação:
40 g ---------- 100%
30 g ---------- x
x = 75%
D) Calcule a quantidade, em gramas, de HCl necessária para reagir completamente com 387 g de uma amostra, contendo, em massa, 32,8% de MgCO3 e 67,2% de Mg(OH)2 . Considere rendimento teórico (100%).
São duas estequiometrias para a resolução do item:
1) Massa de HCl para neutralizar 127 g de MgCO3
2) Massa de HCl para neutralizar 260 g de Mg(OH)2
Resposta: somar as duas massas.
Espero ter ajudado, qualquer coisa só responder
d = C/T --> 1,15 g/cm³ = C/0,26 --> C = 0,299 g/cm³ = 299 g/L
Dado M(HCl) = 36,5 g/mol
[HCl] = C/M = (299 g/L)/ (36,5 g/mol) = 8,192 ≈ 8,2 mol/L
B) Calcule o volume, em mL, de uma solução aquosa de HCl 0,128 mol L-1 necessário para reagir completamente com 2,87 g de hidróxido de magnésio, Mg(OH)2.
2HCl + Mg(OH)2 --> MgCl2 + 2 H2O
Proporção estequiométrica
Dado: M(Mg(OH)2) = 58 g/mol
2 mol HCl -------- 1 mol Mg(OH)2
2.(36,5) g HCl ------ 58 g
m ------------------ 2,87 g
m = 3,6 g de HCl
[HCl] = n/V --> V = n / [HCl]
n = m/M(HCl)
V = m/ (M(HCl).[HCl]) ≈ 770 mL
C) Calcule a quantidade máxima, em massa, de MgCl2, quando 0,420 mol de carbonato de magnésio, MgCO3, reage com excesso de HCl. Calcule o rendimento percentual desta reação sabendo que foram produzidos 30,0 g de cloreto de magnésio, MgCl2.
Dado: M (MgCl2) = 95 g/mol
Reação:
MgCO3(s) + 2HCl(aq) → MgCl2 (aq)+ H2O(l) + CO2(g)
1 mol ---------------- 95 g
0,42 mol -------------- m
m = 39,9 g de MgCl2 ≈ 40 g de MgCL2
Rendimento da reação:
40 g ---------- 100%
30 g ---------- x
x = 75%
D) Calcule a quantidade, em gramas, de HCl necessária para reagir completamente com 387 g de uma amostra, contendo, em massa, 32,8% de MgCO3 e 67,2% de Mg(OH)2 . Considere rendimento teórico (100%).
São duas estequiometrias para a resolução do item:
1) Massa de HCl para neutralizar 127 g de MgCO3
2) Massa de HCl para neutralizar 260 g de Mg(OH)2
Resposta: somar as duas massas.
Espero ter ajudado, qualquer coisa só responder

schow- Jedi

- Mensagens : 446
Data de inscrição : 03/01/2013
Idade : 28
Localização : Fortaleza-CE
 Re: Concentração
Re: Concentração
d=C/T
O que seria o T ?
Muito obrigado pela ajuda desde já
O que seria o T ?
Muito obrigado pela ajuda desde já

vzz- Jedi

- Mensagens : 336
Data de inscrição : 16/02/2013
Localização : Rio de Janeiro, Rio de Janeiro, Brasil
 Re: Concentração
Re: Concentração
T seria o título em massa --> (T (HCl) = 0,26
;]
;]

schow- Jedi

- Mensagens : 446
Data de inscrição : 03/01/2013
Idade : 28
Localização : Fortaleza-CE
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













