Propriedades periódicas
2 participantes
Página 1 de 1
 Propriedades periódicas
Propriedades periódicas
duas dúvidas que me apareceram:
1ª: Por que a energia de ionização e a afinidade eletrônica são feitas com o átomo no estado gasoso e não em outro estado físico?
2ª: : Por que um átomo que tem maior afinidade por elétrons, libera mais energia e por quê?
1ª: Por que a energia de ionização e a afinidade eletrônica são feitas com o átomo no estado gasoso e não em outro estado físico?
2ª: : Por que um átomo que tem maior afinidade por elétrons, libera mais energia e por quê?

GabiCastro- Recebeu o sabre de luz

- Mensagens : 115
Data de inscrição : 28/07/2019
Idade : 23
Localização : Tracunhaém, Pernambuco, Brasil
 Re: Propriedades periódicas
Re: Propriedades periódicas
Oi!
Sobre a primeira dúvida, eu pesquisei e achei essa pequena explicação no https://www.infoescola.com/quimica/energia-de-ionizacao/ :
"O termo fundamental expressa neste caso o estado gasoso, uma vez que o átomo está livre de influências de átomos vizinhos; está isolado."
A respeito da segunda, um átomo que tem grande afinidade por elétrons tem alta eletronegatividade, ou seja, grande capacidade de atrair elétrons. O átomo tem, então, um pequeno raio(raio atômico e eletronegatividade são propriedades inversas), logo, a atração núcleo-elétron é maior, necessitando de grande quantidade de energia para liberar o último.
Aqui está a relação entre o raio e a eletronegatividade para elucidar melhor:
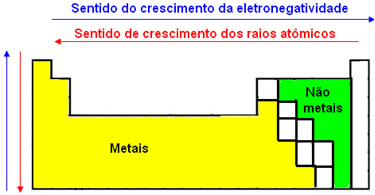
Se não tiver ficado claro, me avise. Bons estudos
Sobre a primeira dúvida, eu pesquisei e achei essa pequena explicação no https://www.infoescola.com/quimica/energia-de-ionizacao/ :
"O termo fundamental expressa neste caso o estado gasoso, uma vez que o átomo está livre de influências de átomos vizinhos; está isolado."
A respeito da segunda, um átomo que tem grande afinidade por elétrons tem alta eletronegatividade, ou seja, grande capacidade de atrair elétrons. O átomo tem, então, um pequeno raio(raio atômico e eletronegatividade são propriedades inversas), logo, a atração núcleo-elétron é maior, necessitando de grande quantidade de energia para liberar o último.
Aqui está a relação entre o raio e a eletronegatividade para elucidar melhor:

Se não tiver ficado claro, me avise. Bons estudos

fernandalnh- Recebeu o sabre de luz

- Mensagens : 132
Data de inscrição : 02/02/2021
Idade : 21
Localização : Macapá, AP
 Tópicos semelhantes
Tópicos semelhantes» Propriedades periódicas ²
» Propriedades Periodicas
» Propriedades Periódicas
» Propriedades Periodicas
» Propriedades periódicas
» Propriedades Periodicas
» Propriedades Periódicas
» Propriedades Periodicas
» Propriedades periódicas
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













