UFSC .......
2 participantes
Página 1 de 1
 UFSC .......
UFSC .......
Os catalisadores automotivos são formados por uma “colméia” metálica ou cerâmica,
impregnada por uma mistura de paládioródio (para veículos a gasolina) ou paládio molibdênio (para veículos a álcool). Esses dispositivos têm a função de converter gases nocivos, dentre eles os óxidos de nitrogênio (NOx) e o monóxido de carbono (CO), em substâncias menos prejudiciais à saúde (CO2 e N2). Uma das reações que ocorre nos catalisadores é representada pela equação não
balanceada:
CO(g) + NO(g) ⇔ CO2(g) + N2(g) ∆H < 0
Considere que num recipiente fechado contendo inicialmente 3 mol de monóxido de carbono e 2 mol de monóxido de nitrogênio, o equilíbrio foi estabelecido quando 90% de monóxido de nitrogênio foi consumido.
Com base nas informações fornecidas e na equação balanceada, assinale a(s) proposição(ões) CORRETA(S).
04. No equilíbrio, a quantidade de monóxido de carbono no recipiente é de 1,2 mol.
16. A quantidade total de mol de gases, no equilíbrio, é igual a 4,1.
impregnada por uma mistura de paládioródio (para veículos a gasolina) ou paládio molibdênio (para veículos a álcool). Esses dispositivos têm a função de converter gases nocivos, dentre eles os óxidos de nitrogênio (NOx) e o monóxido de carbono (CO), em substâncias menos prejudiciais à saúde (CO2 e N2). Uma das reações que ocorre nos catalisadores é representada pela equação não
balanceada:
CO(g) + NO(g) ⇔ CO2(g) + N2(g) ∆H < 0
Considere que num recipiente fechado contendo inicialmente 3 mol de monóxido de carbono e 2 mol de monóxido de nitrogênio, o equilíbrio foi estabelecido quando 90% de monóxido de nitrogênio foi consumido.
Com base nas informações fornecidas e na equação balanceada, assinale a(s) proposição(ões) CORRETA(S).
04. No equilíbrio, a quantidade de monóxido de carbono no recipiente é de 1,2 mol.
16. A quantidade total de mol de gases, no equilíbrio, é igual a 4,1.
Aline P- Padawan

- Mensagens : 80
Data de inscrição : 26/02/2013
Idade : 29
Localização : São Borja,RS, Brasil
 Re: UFSC .......
Re: UFSC .......
Primeiro de tudo, vamos balancear a equação dada:
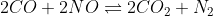
Montamos uma tabela e completamos seus valores, como segue:

Perceba que a primeira linha é toda dada pelo enunciado. Pra montar a segunda linha usei uma informação do enunciado, que é a de que reagem 90% de todo o NO, então 0,9 x 3 mol = 1,8 mol de NO consumidos. Como a reação deve seguir a estequiometria, todos reagirão na razão de seus número estequiométricos. Assim, completamos a segunda linha.
A terceira linha é a subtração do início por aquilo que reagiu (para reagentes já que eles são consumidos). E para os produtos somamos o que havia no começo com o que reagiu. Completamos a terceira linha.
A tabela, por si só, responde a afirmação 04: No equilíbrio temos 1,2 mols de monóxido de carbono
Somando a última linha da tabela temos o total de mols no equilíbrio: 1,2 + 0,2 + 1,8 + 0,9 = 4,1
Assim a 16 está correta, também.
Está respondido, Qualquer dúvida poste!
Abraço
Montamos uma tabela e completamos seus valores, como segue:

Perceba que a primeira linha é toda dada pelo enunciado. Pra montar a segunda linha usei uma informação do enunciado, que é a de que reagem 90% de todo o NO, então 0,9 x 3 mol = 1,8 mol de NO consumidos. Como a reação deve seguir a estequiometria, todos reagirão na razão de seus número estequiométricos. Assim, completamos a segunda linha.
A terceira linha é a subtração do início por aquilo que reagiu (para reagentes já que eles são consumidos). E para os produtos somamos o que havia no começo com o que reagiu. Completamos a terceira linha.
A tabela, por si só, responde a afirmação 04: No equilíbrio temos 1,2 mols de monóxido de carbono
Somando a última linha da tabela temos o total de mols no equilíbrio: 1,2 + 0,2 + 1,8 + 0,9 = 4,1
Assim a 16 está correta, também.
Está respondido, Qualquer dúvida poste!
Abraço
gabrielferreira95- Padawan

- Mensagens : 62
Data de inscrição : 10/04/2013
Idade : 28
Localização : Sta Cruz do Rio Pardo
natalia23456789 gosta desta mensagem
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













