(ITA) Eletrólito e KPS
2 participantes
Página 1 de 1
 (ITA) Eletrólito e KPS
(ITA) Eletrólito e KPS
O produto de Solubilidade, PS, do carbonato de cálcio em água vale 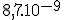 , a 25ºC. Partindo desta informação é CORRETO concluir que:
, a 25ºC. Partindo desta informação é CORRETO concluir que:
a) O valor do PS indica que o carbonato de cálcio deve ser um eletrólito fraco.
b) Espera-se que o PS do carbonato de cálcio quando dissolvido em solução que já contenha íons de cálcio, sejam maior que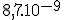 .
.
c) O valor do PS indica que deve ser muito pequena a velocidade com que consegue dissolver carbonato de cálcio em água.
d) Espera-se que o PS de carbonato de cálcio em etanol também valha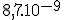
e) Espera-se precipitação de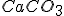 se, a uma solução
se, a uma solução  molar em íons de cálcio, se acrescenta volume igual de solução de igual concentração de íons de carbonato.
molar em íons de cálcio, se acrescenta volume igual de solução de igual concentração de íons de carbonato.
Minha dúvida: Por que a letra A não é verdadeira ? Se o KPS é baixo, isso indica que solução saturada de carbonato de sódio tem poucos íons dissolvidos, logo, um eletrólito fraco.
a) O valor do PS indica que o carbonato de cálcio deve ser um eletrólito fraco.
b) Espera-se que o PS do carbonato de cálcio quando dissolvido em solução que já contenha íons de cálcio, sejam maior que
c) O valor do PS indica que deve ser muito pequena a velocidade com que consegue dissolver carbonato de cálcio em água.
d) Espera-se que o PS de carbonato de cálcio em etanol também valha
e) Espera-se precipitação de
Minha dúvida: Por que a letra A não é verdadeira ? Se o KPS é baixo, isso indica que solução saturada de carbonato de sódio tem poucos íons dissolvidos, logo, um eletrólito fraco.

guipenteado- Jedi

- Mensagens : 373
Data de inscrição : 02/03/2016
Idade : 26
Localização : paranavai
 Re: (ITA) Eletrólito e KPS
Re: (ITA) Eletrólito e KPS
Não se pode confundir os conceitos de ionização e solubilidade.
Dado uma substância qualquer que em água possa sofrer ionização ou dissociação, podemos quantificar essa reação reversível com a constante de equilíbrio de ionização/dissociação:
![AB_{(aq)} \rightleftharpoons A^{+}_{(aq)} + B^{-}_{(aq)} \;\;\;\;\; K_{i} = \frac{[A^{+}][B^{-}]}{[AB]}](https://latex.codecogs.com/gif.latex?AB_{(aq)}&space;\rightleftharpoons&space;A^{+}_{(aq)}&space;+&space;B^{-}_{(aq)}&space;\;\;\;\;\;&space;K_{i}&space;=&space;\frac{[A^{+}][B^{-}]}{[AB]})
Perceba que a constante Ki relaciona a quantidade de soluto dissolvida, com seus íons dissociados. É fácil perceber que para um eletrólito fraco por exemplo, a quantidade de soluto dissolvido irá ser bem maior que a quantidade de íons, e o Ki será baixo.
Em suma: a força de um eletrólito pode ser bem caracterizada pela sua constante de ionização/dissociação, uma vez que a mesma relaciona a quantidade de soluto dissolvida, com os íons dissociados em solução.
Deixando de lado o equilíbrio químico existente numa ionização/dissociação, vamos falar do equilíbrio que envolve um sal pouco solúvel (precipitado) e os poucos íons que se dissociam deste precipitado, como por exemplo nesta reação de equilíbrio:
![CD_{(s)} \rightleftharpoons C^{+}_{(aq)} + C^{-}_{(aq)} \;\;\;\;\; K_{ps} = [C^{+}][D^{-}]](https://latex.codecogs.com/gif.latex?CD_{(s)}&space;\rightleftharpoons&space;C^{+}_{(aq)}&space;+&space;C^{-}_{(aq)}&space;\;\;\;\;\;&space;K_{ps}&space;=&space;[C^{+}][D^{-}])
Perceba que o valor de Kps simplesmente nos informa a quantidade de íons numa solução saturada. É importante para tirarmos conclusões acerca da solubilidade do sal e das pequenas concentrações dos íons envolvidos.
Mas sua pergunta é justamente essa: Se são pequenas as concentrações dos íons em solução, devido a baixa solubilidade pelo valor pequeno de Kps, logo o eletrólito é fraco, certo ?
NÃO!
Veja bem, algumas moléculas do sal podem estar dissolvidas em solução e não estarem dissociadas! A força de um eletrólito é caracterizada justamente por esse lado: A quantidade de soluto dissolvido em solução na forma não ionizada/dissociada (dissolvida) , e os íons que são ionizados/dissociados deste soluto, deu pra entender ?
Existe um outro equilíbrio químico entre o sal que está dissolvido, e os seus íons que se dissociaram:
![CD_{(aq)} \rightleftharpoons C^{+}_{(aq)} + C^{-}_{(aq)} \;\;\;\;\; K_{i} = \frac{[C^{+}][D^{-}]}{[CD]}](https://latex.codecogs.com/gif.latex?CD_{(aq)}&space;\rightleftharpoons&space;C^{+}_{(aq)}&space;+&space;C^{-}_{(aq)}&space;\;\;\;\;\;&space;K_{i}&space;=&space;\frac{[C^{+}][D^{-}]}{[CD]})
É este valor de Ki que vai nos informar a proporção de íons em solução e do eletrólito dissolvido na forma não dissociada. E como sabemos, quanto mais moléculas deste eletrólito dissolvido ficar na forma dissociada, mais forte ele será, e podemos ver isso pelo valor de Ki e não de Kps.
Agora uma prova cabal: AgCl é um sal pouco solúvel, disso ninguém tem dúvidas. Seria então um eletrólito fraco ?? NÃÃOO kk
Pois a maior parte das poucas moléculas de AgCl que dissolvem em solução na sua forma não dissociada "AgCl(aq)" se dissocia e forma íons !
Kps (AgCl(s)) = 1,8 . 10^-10
Ki (AgCl(aq)) = valor relativamente alto.
Existem também sais solúveis, mas que em água quase não se dissociam, sendo portanto fracos. Ser solúvel não significa dizer que o sal ficará dissolvido em solução na sua forma dissociada... Acho que já entendeu.
-----------------------------------------------------------------------------------------------------------------------------
Vou deixar a solução da questão, para uma análise completa:
Basta calcular o Qps (Quociente de solubilidade em condições fora do equilíbrio e comparar com o Kps)
![\\CaCO_{3(s)} \rightleftharpoons Ca^{2+}_{(aq)} + CO^{2-}_{3(aq)} \;\;\;\;\; Q_{ps} = [Ca^{2+}][CO^{2-}]\\\\ Q_{ps} = 10^{-3} \cdot[CO^{2-}] \;\; \rightarrow \;\; [CO^{2-}].V = [CO^{2-}]'\cdot 2V \;\; \rightarrow [CO^{2-}] = \frac{10^{-3}}{2}\\\\ Q_{ps} = 10^{-3} \cdot \frac{10^{-3}}{2} = \boxed{5 \cdot 10^{-7}}\\\\ Q_{ps} > K_{ps}](https://latex.codecogs.com/gif.latex?\\CaCO_{3(s)}&space;\rightleftharpoons&space;Ca^{2+}_{(aq)}&space;+&space;CO^{2-}_{3(aq)}&space;\;\;\;\;\;&space;Q_{ps}&space;=&space;[Ca^{2+}][CO^{2-}]\\\\&space;Q_{ps}&space;=&space;10^{-3}&space;\cdot[CO^{2-}]&space;\;\;&space;\rightarrow&space;\;\;&space;[CO^{2-}].V&space;=&space;[CO^{2-}]'\cdot&space;2V&space;\;\;&space;\rightarrow&space;[CO^{2-}]&space;=&space;\frac{10^{-3}}{2}\\\\&space;Q_{ps}&space;=&space;10^{-3}&space;\cdot&space;\frac{10^{-3}}{2}&space;=&space;\boxed{5&space;\cdot&space;10^{-7}}\\\\&space;Q_{ps}&space;>&space;K_{ps})
Para Qps > Kps a solução pode estar supersaturada, mas como a solução supersaturada é instável, ocorrerá a formação de precipitado e o Qps voltará ao valor de Kps.
Dado uma substância qualquer que em água possa sofrer ionização ou dissociação, podemos quantificar essa reação reversível com a constante de equilíbrio de ionização/dissociação:
Perceba que a constante Ki relaciona a quantidade de soluto dissolvida, com seus íons dissociados. É fácil perceber que para um eletrólito fraco por exemplo, a quantidade de soluto dissolvido irá ser bem maior que a quantidade de íons, e o Ki será baixo.
Em suma: a força de um eletrólito pode ser bem caracterizada pela sua constante de ionização/dissociação, uma vez que a mesma relaciona a quantidade de soluto dissolvida, com os íons dissociados em solução.
Deixando de lado o equilíbrio químico existente numa ionização/dissociação, vamos falar do equilíbrio que envolve um sal pouco solúvel (precipitado) e os poucos íons que se dissociam deste precipitado, como por exemplo nesta reação de equilíbrio:
Perceba que o valor de Kps simplesmente nos informa a quantidade de íons numa solução saturada. É importante para tirarmos conclusões acerca da solubilidade do sal e das pequenas concentrações dos íons envolvidos.
Mas sua pergunta é justamente essa: Se são pequenas as concentrações dos íons em solução, devido a baixa solubilidade pelo valor pequeno de Kps, logo o eletrólito é fraco, certo ?
NÃO!
Veja bem, algumas moléculas do sal podem estar dissolvidas em solução e não estarem dissociadas! A força de um eletrólito é caracterizada justamente por esse lado: A quantidade de soluto dissolvido em solução na forma não ionizada/dissociada (dissolvida) , e os íons que são ionizados/dissociados deste soluto, deu pra entender ?
Existe um outro equilíbrio químico entre o sal que está dissolvido, e os seus íons que se dissociaram:
É este valor de Ki que vai nos informar a proporção de íons em solução e do eletrólito dissolvido na forma não dissociada. E como sabemos, quanto mais moléculas deste eletrólito dissolvido ficar na forma dissociada, mais forte ele será, e podemos ver isso pelo valor de Ki e não de Kps.
Agora uma prova cabal: AgCl é um sal pouco solúvel, disso ninguém tem dúvidas. Seria então um eletrólito fraco ?? NÃÃOO kk
Pois a maior parte das poucas moléculas de AgCl que dissolvem em solução na sua forma não dissociada "AgCl(aq)" se dissocia e forma íons !
Kps (AgCl(s)) = 1,8 . 10^-10
Ki (AgCl(aq)) = valor relativamente alto.
Existem também sais solúveis, mas que em água quase não se dissociam, sendo portanto fracos. Ser solúvel não significa dizer que o sal ficará dissolvido em solução na sua forma dissociada... Acho que já entendeu.
-----------------------------------------------------------------------------------------------------------------------------
Vou deixar a solução da questão, para uma análise completa:
Basta calcular o Qps (Quociente de solubilidade em condições fora do equilíbrio e comparar com o Kps)
Para Qps > Kps a solução pode estar supersaturada, mas como a solução supersaturada é instável, ocorrerá a formação de precipitado e o Qps voltará ao valor de Kps.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: (ITA) Eletrólito e KPS
Re: (ITA) Eletrólito e KPS
Thálisson, primeiro gostaria de agradecer ao modesto tratado de química que acabara de escrever kkk
Porém, ainda ficaram algumas situações confusas na minha cabeça. Nunca tinha ouvido sobre a formação de AgCl(aq), ou seja, dissolvido porém não dissociado. Em ácidos isso fica claro pois, sendo um composto molecular, formado por ligações covalentes, precisa sofrer ionização para formar íons, e um composto com baixa constante de ionização formará uma uma pequena quantidade de produto.
Entretanto, para sais pensava que, por ser compostos iônicos, as reações seriam apenas no sentido
"sólidos->íons". Está um tanto quanto difícil de "enxergar" como é possível um composto iônico existir na forma aquosa sem estar dissociado! Ainda tenho muito a aprender, rs.
Por fim, para saber se entendi: na internet encontrei a informação de que o HgCl2 é um sal solúvel, entretanto, um eletrólito fraco. Sendo assim, quer dizer que, embora grande parte do HgCl2(s) se dissolva em água, na forma de HgCl2(aq), apenas uma pequena quantidade se dissociará em forma de íons ?
Porém, ainda ficaram algumas situações confusas na minha cabeça. Nunca tinha ouvido sobre a formação de AgCl(aq), ou seja, dissolvido porém não dissociado. Em ácidos isso fica claro pois, sendo um composto molecular, formado por ligações covalentes, precisa sofrer ionização para formar íons, e um composto com baixa constante de ionização formará uma uma pequena quantidade de produto.
Entretanto, para sais pensava que, por ser compostos iônicos, as reações seriam apenas no sentido
"sólidos->íons". Está um tanto quanto difícil de "enxergar" como é possível um composto iônico existir na forma aquosa sem estar dissociado! Ainda tenho muito a aprender, rs.
Por fim, para saber se entendi: na internet encontrei a informação de que o HgCl2 é um sal solúvel, entretanto, um eletrólito fraco. Sendo assim, quer dizer que, embora grande parte do HgCl2(s) se dissolva em água, na forma de HgCl2(aq), apenas uma pequena quantidade se dissociará em forma de íons ?

guipenteado- Jedi

- Mensagens : 373
Data de inscrição : 02/03/2016
Idade : 26
Localização : paranavai
 Re: (ITA) Eletrólito e KPS
Re: (ITA) Eletrólito e KPS
guipenteado escreveu:Sendo assim, quer dizer que, embora grande parte do HgCl2(s) se dissolva em água, na forma de HgCl2(aq), apenas uma pequena quantidade se dissociará em forma de íons ?
Exatamente !
Lembre-se que toda ligação iônica tem um caráter covalente (por menor que seja) e toda ligação covalente também possui um caráter iônico. Então é perfeitamente possível você aceitar que um sal pode se dissolver, mas não se dissociar, como no casos dos ácidos que você já aceita...
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: (ITA) Eletrólito e KPS
Re: (ITA) Eletrólito e KPS
Muito obrigado pela explicação! Esclarecedor!

guipenteado- Jedi

- Mensagens : 373
Data de inscrição : 02/03/2016
Idade : 26
Localização : paranavai
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













