Soluções
3 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Soluções
Soluções
Para se determinar a concentração de uma solução de hidróxido de sódio, um estudante extraiu uma
alíquota de 50,00 mL e, utilizando um balão volumétrico, avolumou para 250,0 mL. Desta diluição, ele
extraiu 20,00 mL e titulou com uma solução de ácido sulfúrico com a concentração de 0,2 mol/L. O
volume de ácido gasto foi de 18,50 mL. A concentração da solução inicial de hidróxido de sódio é de
alíquota de 50,00 mL e, utilizando um balão volumétrico, avolumou para 250,0 mL. Desta diluição, ele
extraiu 20,00 mL e titulou com uma solução de ácido sulfúrico com a concentração de 0,2 mol/L. O
volume de ácido gasto foi de 18,50 mL. A concentração da solução inicial de hidróxido de sódio é de
- Spoiler:
- 1,85mol/L
shady17- Jedi

- Mensagens : 322
Data de inscrição : 23/05/2013
Idade : 32
Localização : Uberlândia MG
 Re: Soluções
Re: Soluções
Eae blz ?
Creio que o 20,00 ml no caso seja 200 ml, estou supondo pelo fato de eu ter feito a questão e encontrado 18,5 mol, caso esteja errado deixo para os outros resolverem ....
vamos lá :
Pela reação de neutralização do hidróxido de sódio com o ácido sulfúrico temos:
2NaOH + H2SO4 ---------> 2H2O + Na2SO4
No final do enunciado ele afirmou ter titulado 20 ml de NaOH com 18,5 ml de ácido sulfúrico 0,2mol/L.
0,2 mol ------ 1 L
x mol ------ 18,5 x 10 ^-³ L
x = 3,7 x 10^-³ mol de H2SO4
como na reação 2 mol de NaOH reage com 1 mol de H2SO4, temos:
2 mol NaOH ---- 1 mol H2SO4
y mol NaOH ---- 3,7 x 10 ^-³
y = 7,4 x 10^-³ mol de NaOH.
ou seja temos 7,4 x 10 ^-³ mol de NaOH a cada 200 ml = 200 x 10 ^-³
Agora basta fazer todo caminho inverso com as regras de três ....
7,4 x 10 ^-³ mol ---- 200 x 10 ^-³L
x mol -------- 250 x 10 ^-³
x = 9,25 x 10 ^-³ mol
9,25 x 10 ^-³ mol -------- 250 x 10 ^-³ L
x mol ------------- 50 x 10 ^-³ L
x = 1,85 x 10 ^-³ mol
C = M/V 1,85 x 10 ^-³ mol/10 ^-³L = 1,85 mol/L
Abraço!
Creio que o 20,00 ml no caso seja 200 ml, estou supondo pelo fato de eu ter feito a questão e encontrado 18,5 mol, caso esteja errado deixo para os outros resolverem ....
vamos lá :
Pela reação de neutralização do hidróxido de sódio com o ácido sulfúrico temos:
2NaOH + H2SO4 ---------> 2H2O + Na2SO4
No final do enunciado ele afirmou ter titulado 20 ml de NaOH com 18,5 ml de ácido sulfúrico 0,2mol/L.
0,2 mol ------ 1 L
x mol ------ 18,5 x 10 ^-³ L
x = 3,7 x 10^-³ mol de H2SO4
como na reação 2 mol de NaOH reage com 1 mol de H2SO4, temos:
2 mol NaOH ---- 1 mol H2SO4
y mol NaOH ---- 3,7 x 10 ^-³
y = 7,4 x 10^-³ mol de NaOH.
ou seja temos 7,4 x 10 ^-³ mol de NaOH a cada 200 ml = 200 x 10 ^-³
Agora basta fazer todo caminho inverso com as regras de três ....
7,4 x 10 ^-³ mol ---- 200 x 10 ^-³L
x mol -------- 250 x 10 ^-³
x = 9,25 x 10 ^-³ mol
9,25 x 10 ^-³ mol -------- 250 x 10 ^-³ L
x mol ------------- 50 x 10 ^-³ L
x = 1,85 x 10 ^-³ mol
C = M/V 1,85 x 10 ^-³ mol/10 ^-³L = 1,85 mol/L
Abraço!

Shino- Jedi

- Mensagens : 245
Data de inscrição : 18/04/2015
Idade : 25
Localização : Londrina, Paraná.
 Re: Soluções
Re: Soluções
Valeu Shino.
Essa é uma questão da Olimpíada de Química do RJ e na prova consta sendo 20,00mL mesmo, e o gabarito oficial é esse.
Podem ser que eles tenha errado, mas a princípio é isso.
Obrigado.
Essa é uma questão da Olimpíada de Química do RJ e na prova consta sendo 20,00mL mesmo, e o gabarito oficial é esse.
Podem ser que eles tenha errado, mas a princípio é isso.
Obrigado.
shady17- Jedi

- Mensagens : 322
Data de inscrição : 23/05/2013
Idade : 32
Localização : Uberlândia MG
 Re: Soluções
Re: Soluções
Pode ser que eu mesmo tenha me equivocado em algum cálculo hahaha, porém refiz com 20ml e o resultado de fato é 18,5 ml. Porém creio que o princípio da questão é esse! Um grande abraço!!

Shino- Jedi

- Mensagens : 245
Data de inscrição : 18/04/2015
Idade : 25
Localização : Londrina, Paraná.
 Re: Soluções
Re: Soluções
Primeiro balanceamos a equação:

Calculamos a nova concentração no balão:
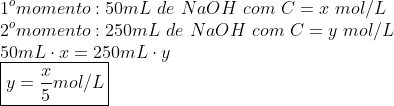
Montamos uma "tabela" com os dados até o momento:
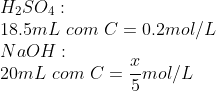
Calculamos a quantidade de matéria de ácido sulfúrico:
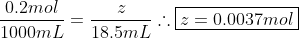
Considerando os coeficientes da equação, multiplicamos "z" por 2 e calculamos sua concentração inicial e chegamos à resposta:
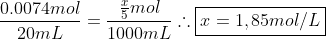
Calculamos a nova concentração no balão:
Montamos uma "tabela" com os dados até o momento:
Calculamos a quantidade de matéria de ácido sulfúrico:
Considerando os coeficientes da equação, multiplicamos "z" por 2 e calculamos sua concentração inicial e chegamos à resposta:
pedrim27- Mestre Jedi

- Mensagens : 517
Data de inscrição : 30/10/2014
Idade : 25
Localização : Minas Gerais,Brasil
 Re: Soluções
Re: Soluções
Obrigado Pedrim.
shady17- Jedi

- Mensagens : 322
Data de inscrição : 23/05/2013
Idade : 32
Localização : Uberlândia MG
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













